Структура и свойства дисперсий на основе катионактивного ПАВ, эфира ненасыщенной жирной кислоты, используемых как среда для проведения реакций свободно-радикального окисления
Конференция: XI Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Коллоидная химия

XI Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Структура и свойства дисперсий на основе катионактивного ПАВ, эфира ненасыщенной жирной кислоты, используемых как среда для проведения реакций свободно-радикального окисления
Structure and properties of dispersionsbased on cationic surfactants, ester of unsaturated fatty acid used as the medium for conducting reactions of free radical oxidation
Lydmila Zhuravleva
associate Professor, candidate of chemical Sciences, Surgut state University, Russia, Surgut
Olesya Nikiforova
Student, Surgut state University, Russia, Surgut
Аннотация. Рефрактометрически установлена солюбилизационная емкость сложной многокомпонентной системы, используемой как среда реакции свободно-радикального окисления липидов. Установлены размеры дисперсий окисляемого субстрата, предложена их структура, что позволяет объяснить проявление антиоксидантных свойств нерастворимых в воде антиоксидантов, уточнить механизм действия в условиях водно-липидной кинетической модели.
Abstract. Refractometrically solubilization installed capacity complex multi-component systems used as reaction media of free-radical oxidation of lipids. The sizes of dispersions of oxidizable substrate are established, their structure is offered that allows to explain manifestation of antioxidant properties of water-insoluble antioxidants and to specify the mechanism of action in the conditions of water-lipid kinetic model.
Ключевые слова: солюбилизация; антиоксиданты; коллоидные системы; субстрат; поверхностно-активные вещества; критическая концентрация мицеллообразования.
Keywords: solubilization; antioxidants; colloidal systems; substrate; surfactants; critical micellar concentration.
Микрогетерогенные коллоидные системы проявляют ряд уникальных свойств, которые определяют все новые области их применения [12, с. 9621], [13, с. 849]. Одним из таких свойств является солюбилизирующая способность, т. е. концентрирование в гидрофобной части мицелл нерастворимых в данной дисперсионной среде веществ. В настоящее время такие системы широко используются как среда для проведения некоторых реакций [8, с. 251], [11, с. 2021]. За счет процесса солюбилизации субстрат и реагент, даже значительно различающиеся по гидрофильности концентрируются на поверхности раздела фаз, обеспечивая эффективный контакт реагентов и значительное увеличение скорости протекания реакции [5, с. 1145], [10, с. 679].
Предыдущие исследования показали эффективность использования водно-липидного субстрата для проведения реакций свободно-радикального окисления липидов (СРОЛ). Установлена в 100-1000 раз более высокая скорость эмульсионного окисления по сравнению с окислением соответствующих липидов в гомогенной среде [1, с. 144], [3, с. 66]. Установлена высокая или значительная антиоксидантная активность водонерастворимых антиоксидантов в условиях водно-липидной кинетической модели [4, с. 154], [9, с. 222]. Что можно объяснить высокой солюбилизационной емкостью (S) и особым структурированием субстрата под действием катализатора. Это обеспечивает образование высокоразвитой поверхности раздела фаз и эффективный контакт субстрата и реагента за счет их концентрирования в полярной и углеводородной фазах, что значительно влияет на кинетику процесса.
Целью настоящей работы является определение солюбилизационной емкости окисляемого субстрата состава «ПАВ – липид – катализатор – Н2О» по отношению к ионолу (2,6-дитретбутил-4-метилфенолу) и установление структуры дисперсии.
В качестве эмульгатора выбрали катионактивный ПАВ бромид триметилцетиламмония, поскольку анализ публикаций показал, что катионактивные ПАВ увеличивают скорость СРОЛ, анионактивные и неионогенные ПАВ не влияют на кинетику процесса [9, с. 222]. Окисляемым субстратом выбрали метиллинолеат поскольку данный липид имеет оптимальную скорость окисления. Компоненты коллоидной системы взяты в критической концентрации мицеллообразования (ККМ).
Предыдущие исследования показали высокую каталитическую активность катионов меди(II), которые действуют как узко специфичный катализатор, максимальная активность которого проявляется в интервале концентраций (1·10-3 – 3·10-3 М) [13], [14]. Для исследования коллоидной системы взяли концентрацию катионов меди (II), при которой скорость неингибированного процесса СРОЛ максимальна.
Далее, рефрактометрически исследовали солюбилизационную емкость водно-липидного субстрата состава «ЦТМАБ – МЛ – Cu2+ – Н2О» по отношению к ионолу в интервале концентраций от 6,6∙10-6 до 1,4∙10-2 моль/л.
Ионол относится к синтетическим ингибиторам СРО углеводородов. Нерастворим в воде, но в условиях водно-липидной кинетической модели проявляет высокие антиоксидантные свойства, потому его использовали в качестве внешнего стандарта при определении эффективности био- и антиоксидантов [3, с. 66], [9, с. 222].
Таким образом, остается актуальным исследование солюбилизационной емкости окисляемого субстрата по отношению к липидрастворимым антиоксидантам для объяснения их антиоксидантной активности в гетерогенной среде и уточнения механизма взаимодействия.
В настоящей работе бромид триметилцетиламмония очищали двукратным переосаждением из этанольного раствора диэтиловым эфиром. Метиллинолеат использовали без дополнительной очистки. Ионол (2,6- дитретбутил-4-метилфенол) марки «ч.» очищали двукратной кристаллизацией из абсолютного этанола при температуре 68,5 ℃. Для приготовления растворов и коллоидных систем использовали бидистиллированную воду.
Критическую концентрацию мицеллообразования определяли методом Ребиндера и кондуктометрическим методом. Для этого методом двойного разбавления готовили серию растворов ЦТМАБ, МЛ и их смеси в интервале концентраций 1∙10-2 – 1∙10-6 моль/л. По экспериментальным данным строили изотермы поверхностного натяжения и электропроводности, по излому которых определяли ККМ. Типичные изотермы приведены на рис.1
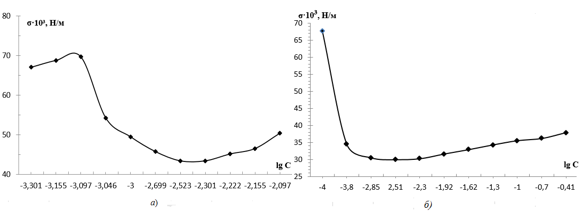
Рисунок 1. Типичные изотермы системы «ЦТМАБ – Н2О» при Т = const: а) изотерма поверхностного натяжения; б) изотерма электропроводности
Величины ККМ, установленные данными методами имеют сходимые результаты и согласуются с литературными данными [7, с. 280]. На основании полученных данных были выбраны концентрации сложной многокомпонентной системы «ЦТМАБ(1∙10-3М) – МЛ(3∙10-3М) – Cu2+(2∙10-3 М) – Н2О».
Солюбилизацию ионола исследовали рефрактометрически на приборе ИРФ – 454 Б2М при температуре 23,0 ± 0,1 ℃. По методу А.И. Юрженко установили количество солюбилизированного ионола и солюбилизационную емкость водно-липидной коллоидной системы. По экспериментальным значениям коэффициента рефракции исследованной системы строили зависимость показателя преломления от концентрации солюбилизированного вещества и по максиму определяли достижение состояния насыщения. Типичная зависимость показателя преломления от концентрации ионола приведена на рис. 2.

Рисунок 2. Зависимость показателя преломления (nD) системы «ЦТМАБ – МЛ – Cu2+ – Н2О» от концентрации ионола

Рисунок 3. Схема мицеллы
Однако, данная величина только ориентировочно позволяет судить о количестве солюбилизированного вещества. Реальное количество ионола, солюбилизированного коллоидной системой при любой степени насыщения определяли по правилу аддитивности удельной рефракции по методу, предложенному в работе Потешновой М.В. [6, с. 185]. Установили, что солюбилизационная емкость исследованной системы составила 0,85 моль ионола на 1 моль ПАВ (ЦТМАБ).
Полученные результаты свидетельствуют, по-видимому, о том, что ионол локализуется в гидрофобной части мицеллы. Это является причиной высокой антиоксидантной активности данного соединения в условиях водно-эмульсионной кинетической модели. Таким образом, можно предположить следующее строение дисперсии: под действием катионов меди (II) идет обращение молекул МЛ, которые стабилизируются молекулами ЦТМАБ путем образования двойного липидного слоя. Внешнюю поверхность мицеллы образуют полярные головки ЦТМАБ, а внутреннюю – поляризованные группы МЛ (рис. 3). Данная структура мицелл окисляемого субстрата позволяет объяснить и проявление антиоксидантных свойств нерастворимых в воде соединений, и увеличение скорости СРО в условиях водно-эмульсионной кинетической модели. Поскольку молекулы ионола, солюбилизированные субстратом, локализуются в двойном липидном слое, то им становятся доступны пероксид радикалы и гидропероксидные группы, т. е. торможение окисления происходит за счет участия ингибитора (InH) в реакциях обрыва цепей[1]:
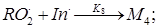 (8)
(8)
 (12)
(12)
Исследования показали, что в условиях водно-липидной кинетической модели механизм окисления усложняется за счет участия антиоксиданта в реакциях разветвления цепей:
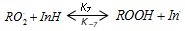 , (7)
, (7)
это подтверждает предположение о структуре дисперсий окисляемого субстрата.
Для проверки этой гипотезы на приборе Microtrac c использованием программы NanoUltra.Zeta были установлены размеры исследованных коллоидных систем (рис. 4).
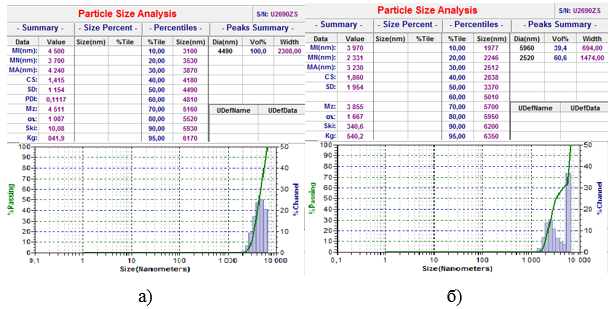
Рисунок 4 – Результаты определения размеров дисперсий состава: а) «ЦТМАБ – МЛ – Н2О» б) «ЦТМАБ – МЛ – Cu2+ – Н2О»
Эмульсия состава «ЦТМАБ – МЛ – Н2О» проявляет стремление к расслоению, что, вероятно, связано с образованием дисперсий типа – прямые мицеллы «ЦТМАБ – Н2О», размер которых увеличился за счет солюбилизации метиллинолеата варьируется от 351 нм до 5902 нм. Данная система неустойчива и полностью расслаивается на две фракции в течение 3 часов.
Дисперсии состава «ЦТМАБ – МЛ – Cu2+ – Н2О» имеют средний размер 4490 нм (100 %). Установлено, что данная дисперсная система проявляет высокую устойчивость, что подтверждает структурирование молекул ПАВ и метиллинолеата под действием катионов меди (рис. 3). Взаимодействие поляризованных головок МЛ с катионами меди(II) обеспечивает образование внутренней части дисперсии, а за счет образования двойного липидного слоя гидрофобными хвостами МЛ и ЦТМАБ образуется внешняя оболочка из заряженных четвертичных аминогрупп ЦТМАБ. Значение солюбилизационной емкости исследованной системы меньше единицы, что свидетельствует о локализации молекул ионола в углеводородном слое мицелл, что согласуется с результатами других авторов [6, с. 185].
Данная коллоидная система проявляет высокую устойчивость. Проявление антиоксидантной активности ионола в условиях водно-липидной кинетической модели можно объяснить обеспечением эффективного контакта субстрата и реагента, что позволяет тестировать нерастворимые в воде вещества за счет высокой солюбилизационной емкости окисляемого субстрата. Структура дисперсий позволяет уточнить механизм действия антиоксидантов в водно-эмульсионной кинетической модели.
[1] Механизм СРО углеводородов описывается отдельными стадиями и реакциями, которые имеют единое обозначение.


