Изучение растворимости и разработка спектрофотометрического анализа 4-(4-нитрофенилазо)-3-хлорфенола
Конференция: XVI Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Медицинская химия

XVI Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Изучение растворимости и разработка спектрофотометрического анализа 4-(4-нитрофенилазо)-3-хлорфенола
The study of solubility and the development of spectrophotometric analysis of 4-(4-nitrophenylazo)-3-chlorophenol
Alfia Miftakhova
undergraduate KNRTU, Russia, Kazan
Elena Gorelova
candidate of Chemical Sciences, Associate Professor, KNRTU, Russia, Kazan
Farit Khairutdinov
candidate of Chemical Sciences, Associate Professor, KNRTU, Russia, Kazan
Ruslan Gilmanov
doctor of Chemical Sciences, Professor, KNRTU, Russia, Kazan
Natalya Levushkina
undergraduate 2nd year KNRTU, Russia, Kazan
Аннотация. В данной работе исследована растворимость 4-(4-нитрофенилазо)-3-хлорфенола в растворителях различной природы. Предложен и апробирован спектрофотометрический метод анализа 4-(4-нитрофенилазо-)-3-хлорфенола. Определены молярные коэффициенты поглощения в этиловом и изопропиловом спиртах.
Abstract. In this paper, the solubility of 4- (4-nitrophenylazo)-3‑chlorophenol in solvents of various types has been studied. A spectrophotometric method for analyzing 4- (4-nitrophenylazo) -3-chlorophenol was proposed and tested. The molar absorption coefficients in ethyl and isopropyl alcohols are determined.
Ключевые слова: растворимость; 4-(4-нитрофенилазо)-3-хлорфенол; оптическая плотность; молярный коэффициент поглощения.
Keywords: the solubility; 4-(4-nitrophenylazo)-3-chlorophenol; optical density; molar absorption coefficient.
Длительное применение химико-фармацевтических препаратов является одним из факторов, способствующих проявлению резистентности, то есть способность возбудителей сопротивляться внешнему воздействию.
Новым этапом в развитии антибактериальных средств явилось открытие антимикробного действия группы азокрасителей. Азосоединения представляют интерес как с практической точки зрения в качестве средств, применяемых в фармацевтической практике, так и с теоретической точки зрения для понимания механизма действия лекарственных веществ.
Впервые группой ученых из Японии [2] был синтезирован 4-(4-нитрофенилазо)-3-хлорфенол (рис.1), обладающий антифунгицидной и антигильментной активностью. Синтезированный 4-(4-нитрофенилазо)-3-хлорфенол представляет собой темно-красные кристаллы с температурой плавления 196°С.
В последнее время на кафедре химии и технологии органических соединений азота (далее ХТОСА) КНИТУ занимаются исследованиями в области производных азосоединений, в частности продолжают изучение физико-химических и химических свойств 4-(4-нитрофенилазо-)-3-хлорфенола (далее Азонол), обладающего биологической активностью в отношении золотистого стафилококка, клещей и бактерий [3].
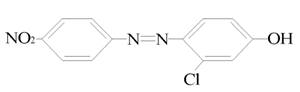
Рисунок 1. Химическая формула 4-(4-нитрофенилазо)-3-хлорфенола
Из литературы известно, что биологическая активность проявляется при наличии у соединения такого параметра как растворимость. Растворимость биологически активного вещества – это способность жизненно важных соединений (ферментов, витаминов, гормонов и пр.) растворяться в биологической жидкости живого организма.
Знание растворимости биологически активных веществ позволит разработать и применить спектрофотометрический анализ для установления качественного и количественного содержания Азонола.
В фармакопейном анализе понятие растворимости приводится в качестве характеристики приблизительной растворимости фармацевтических субстанций и вспомогательных веществ (далее – веществ) при фиксированной температуре. Испытание, если нет других указаний в фармакопейной статье, следует проводить при температуре (20 ± 2) ºC [1].
Спектрофотометрический метод анализа основан на измерении спектров поглощения электромагнитного излучения в оптической области. Данный метод применяется для исследования органических и неорганических веществ, для качественного или количественного определения различных веществ.
Уменьшение интенсивности монохроматического излучения, проходящего через гомогенную поглощающую среду с определенной толщиной, количественно описывается законом Бугера-Ламберта-Бера:
 ,
,  , (1)
, (1)
где: Т – пропускание; I – интенсивность прошедшего монохроматического излучения; I0 – интенсивность падающего монохроматического излучения; ε – молярный показатель поглощения; c – молярная концентрация вещества в растворе; b – длина оптического пути или толщина слоя, см; величина log10(1/T) – оптическая плотность, обозначается буквой А и является измеряемой величиной [4].
При выполнении закона график зависимости оптической плотности от концентрации представляет собой прямую, проходящую через начало координат, а функция зависимости оптической плотности от длины волны имеет один и тот же вид независимо от толщины слоя и концентрации раствора, и положение максимума поглощения сохраняется [4].
Целью данного исследования явились установление растворимости соединения и возможность применения спектрофотометрического метода для качественного определения Азонола в растворе.
В качестве объекта исследования применили Азонол (рис. 1), синтезированный на кафедре ХТОСА КНИТУ. Температура плавления после двукратной перекристаллизации 185°С.
Растворимость Азонола в различных растворителях изучалась по методике [1] при температуре 20°С. Для изучения растворимости использовали следующие растворители марки ч.д.а.: диметилсульфоксид (ДМСО), этиловый спирт, изопропиловый спирт, ацетон, бензол, полиэтиленоксид с молекулярной массой 400. Дополнительную очистку растворителей не проводили. Результаты показали, что Азонол практически нерастворим в дистиллированной воде, ДМСО, хорошо растворим в 96%-ом этиловом спирте, в изопропиловом спирте, полиэтиленоксиде-400, ацетоне, бензоле.
Для определения спектрофотометрических характеристик Азонола в растворе использовали спектрофотометр UV-2600 фирмы Shimadzu с программным обеспечением UVProbe-242, кюветы с толщиной слоя 10 мм.
В качестве растворителей для спектрофотометрического метода были выбраны этиловый и изопропиловый спирты в виду хорошей и быстрой растворимости в них Азонола.
УФ-спектр раствора Азонола с концентрацией 10-5 моль/л в 96%-ом этиловом спирте показал максимальную оптическую плотность А=0,256 при длине волны λ=383,5 нм (рис.2). Молярный коэффициент поглощения ε, определенный по формуле (1), при этой длине волны равен 8,5·103.

Рисунок 2. УФ-спектр Азонола с концентрацией 10-5 моль/л в растворе 96%-ого этилового спирта
В изопропиловом спирте с концентрацией Азонола 5·10-5 моль/л оптическая плотность А=1,142 максимальна при длине волны λ=385,5 нм. Молярный коэффициент поглощения ε для данного раствора, определенный по формуле (1), равен 7,6·103 (рис. 3).
При растворении Азонола в этиловом и изопропиловом спирте окраска вещества сохраняется, что свидетельствует об устойчивости структуры молекулы Азонола при растворении.
Градуировочные графики необходимы для контроля всех факторов, влияющих на содержание основного соединения в составе различных композиций. Для его построения готовили ряд растворов с различной концентрацией исследуемого вещества в этиловом спирте и замеряли их оптическую плотность.
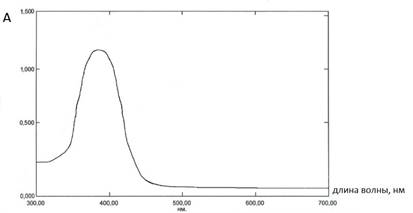
Рисунок 3. УФ-спектр Азонола с концентрацией 5·10-5 моль/л в растворе изопропилового спирта
Ряд растворов Азонола с различной концентрацией был приготовлен из исходного стандартного раствора Азонола с концентрацией 10-3 моль/л. Ряд стандартов с полученными оптическими плотностями для каждой концентрации представлен в таблице 1.
Градуировочный график представлен на рисунке 4.
Таблица 1.
Концентрации стандартных растворов
|
№ |
Концентрация, с×10-4 моль/л |
Оптическая плотность А при λ=383,5 нм |
|
1 |
0,5 |
0,251 |
|
2 |
1,0 |
0,513 |
|
3 |
2,0 |
1,024 |
|
4 |
3,0 |
1,559 |
|
5 |
5,0 |
2,589 |

Рисунок 4. Градуировочный график Азонола в этиловом спирте
График является прямой линией, идущей от начала координат. Характеристика прямой градуировочного графика соответствует критериям закона Бугера-Ламберта-Бера (1). Впоследствии он позволит легко определить концентрацию Азонола в исследуемых растворах, в фармацевтических композициях.
Таким образом, результаты исследования показали, что спектрофотометрический метод анализа можно использовать для качественного и количественного определения Азонола. Отсутствие явного батохромного сдвига возможно свидетельствует о постоянстве структуры Азонола под действием растворителей.


