Структурные изменения сосудов пищевода при компенсированном и декомпенсированном алкогольном циррозе печени
Конференция: XXVII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Патологическая анатомия

XXVII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Структурные изменения сосудов пищевода при компенсированном и декомпенсированном алкогольном циррозе печени
Аннотация. Представлены результаты исследования по выявлению структурных изменений артерий и вен пищевода при алкогольном циррозе печени, а также показано значение этих изменений в развитии компенсации и декомпенсации гемодинамики.
Ключевые слова: цирроз печени; портальная гипертензия; гемодинамика.
Актуальность исследования. Систематическое злоупотребление алкоголем – важнейшая медицинская и социальная проблема современного общества. Воздействие этанола и его метаболитов приводит к развитию необратимых структурных изменений в различных органах, в том числе и в печени, в которой в результате перманентного токсического повреждения, наблюдается нарушение гисто- и ангиоархитектоники. Структурная перестройка органа приводит к формированию цирроза, развитию синдрома портальной гипертензии и открытию портокавальных анастомозов со сбросом венозной крови из портального в кавальный сосудистый бассейн. Наиболее значимым для человека считается портокавальный анастомоз в области нижнего сегмента пищевода, так как варикозное расширение вен этой зоны сопровождается разрывом и массивным смертельным кровотечением. Однако у значительно меньшего числа пациентов со сформированным циррозом долго не отмечается выраженной портальной гипертензии и варикозной трансформации вен пищевода, что, на наш взгляд, является проявлением более совершенной сосудистой компенсации. В литературе, посвященной данной патологии, подробно освещены изменения вен, динамика их развития и исходы. В тоже время, состояние артерий пищевода и их реакция при расстройствах гемодинамики практически не описывается. Хотя хорошо известно, что артериальные сосуды, наряду с венами, могут в значительной степени регулировать и корректировать нарушенное кровообращение. Кроме того в публикациях не полно и достаточно фрагментировано приводятся данные морфометрического исследования сосудов. Все это и предопределило цель нашего исследования.
Цель исследования. Выявление структурных изменений артерий и вен пищевода при алкогольном циррозе печени, а также определение значения этих изменений в развитии компенсации и декомпенсации гемодинамики.
Материал и методы исследования. Объектом исследования послужили 15 мужчин в возрасте от 25 до 50 лет, умерших от пищеводного кровотечения при алкогольном циррозе печени (декомпенсированный цирроз). У 10 мужчин алкогольный цирроз печени протекал без выраженной портальной гипертензии (компенсированный цирроз), а умирали от других причин, не связанных с пищеводным кровотечением. Стаж употребления алкоголя у всех умерших составлял от 10 до 20 лет. В качестве контроля использовали материал от 10 мужчин такого же возраста, непосредственной причиной смерти которых явились травмы. Во всех сериях вырезали кусочки из средней и нижней трети пищевода, фиксировали в 10% нейтральном формалине и заливали в парафин. Гистологические срезы, толщиной не более 5 мкм, окрашивали гематоксилин-эозином, по Масону и фукселином по Харту. Морфометрию артерий и вен выполняли с помощью винтового окуляр-микрометра типа МОВ-1-15х, измеряя внутренний диаметр, толщину медии сосудов, а также толщину интимы артерий. Подсчитывали количество артерий, имеющих в интиме пучки гладкой мускулатуры и сфинктеры. Цифровой материал обрабатывали с помощью программы STATISTICA с использованием t-критерия Стьюдента. Полученные данные считали достоверными, если ошибка средней не превышала 5% (р<0,05).
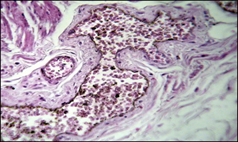
Результаты исследования. При компенсированном алкогольном циррозе печени многослойный плоский эпителий пищевода характеризовался неравномерной толщиной с чередованием участков истончения и утолщения, а также образованием глубоких акантотических тяжей, вдающихся в собственную пластинку (Рисунок 1-2). Мышечная пластинка отчетливо отграничивала слизистую от подслизистой основы. Собственная пластинка и подслизистая основа были значительно увеличены за счет отека и полнокровных расширенных вен и лимфатических сосудов. В прослойках соединительной ткани мышечной оболочки также наблюдался отек. Наиболее выраженные изменения отмечались в сосудистом бассейне пищевода. Так, в собственной пластинке слизистой и подслизистой основе визуализировались, как было указано выше, резко полнокровные вены округлой и неправильной формы, нередко с явлениями стаза. Стенки данных сосудов различного калибра, по сравнению с контролем, были утолщены в результате разрастания в ней гладких миоцитов и, переплетающих их, эластических волоконец.

А. Б.
Рисунок 1 Компенсированный алкогольный цирроз печени:
а - равномерное утолщение стенки вены пищевода; б - варикозная трансформация вен пищевода, образование складок стенок вен и образование мышечно-фиброзных пучков
А. Б.
В.
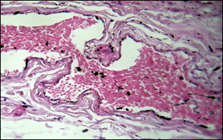
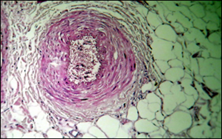
Рисунок 2 Компенсированный алкогольный цирроз печени:
а, б – варикозная трансформация вен пищевода, образование складок стенок вен и образование мышечно-фиброзных пучков; б – гипертонус с гипертрофией медии артерии пищевода; в – гиперэластоз стенки артерии
В некоторых венах стенки имели неравномерную толщину. Кроме, того просвет крупных вен, на продольном срезе, имел зубчатообразный контур за счет того, что в него из стенки глубоко вдавались крупные мышечно-эластические валики. Внутриорганные артерии мышечного типа в пищеводе имели более толстую стенку, по сравнению с контролем, в результате гипертрофии мышечной оболочки. При этом просвет таких артерий суживался, эндотелиоциты интимы вытягивались, а внутренняя эластическая мембрана принимала более складчатый вид. Часто обнаруживались и так называемые артерии замыкающего типа. Они имели утолщенный циркулярный слой гладких миоцитов медии и хорошо развитый слой гладкомышечных клеток в интиме, залегающих продольно по всему периметру, приводящих при сокращении к закрытию просвета. Кроме продольно-ориентированного интимального слоя гладких мышц, охватывающих весь периметр одних артерий, в интиме других встречались отдельные гладкомышечные пучки, в месте обнаружения которых внутренняя эластическая мембрана расщеплялась на две пластинки, образуя дубликатуру. Определялись в артериях и мышечно-эластические сфинктеры, представляющие собой образования, располагающиеся в начальных отделах боковых ветвей, отходящих от более крупных артерий.
Морфометрия показала, что внутренний диаметр артерий уменьшался в 1,2 (р<0,05) раза, а толщина медии увеличивалась – в 1,3 (р<0,05) раза, по сравнению с контролем. Толщина интимы артерий также, как и медия, увеличивалась в 1,3 (р<0,05) раза. Внутренний диаметр вен возрастал в 3 (р<0,05) раза, а толщина стенки – в 1,2 раза, по сравнению с контрольной серией. Количество артерий, имеющих интимальные пучки и сфинктеры, увеличивалось в 2 раза.
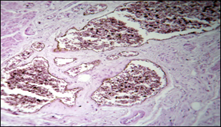

А. Б.
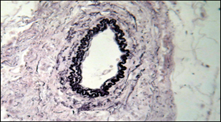
Рисунок 3 Декомпенсированный алкогольный цирроз печени
а – кавернозная трансформация вен пищевода; б – атрофия и склероз стенки артерии
При декомпенсированном алкогольном циррозе многослойный плоский эпителий пищевода в основном был значительно истончен, местами разрушен с образованием эрозий, в дне которых были заметны капилляры грануляций с воспалительным инфильтратом (Рисунок 3). Оставались и участки гиперпластического эпителия с акантозом. Собственная пластинка и подслизистая основа, также как и при компенсированном циррозе, были заметно расширены в результате отека и наличия резко увеличенных вен и лимфатических сосудов. Мышечная пластинка была значительно разволокнена. Мышечная оболочка характеризовалась значительным отеком. Кровеносное русло в условиях декомпенсированного цирроза подвергалось структурной перестройке, кардинально отличающейся от изменений в стадии компенсации. В частности, вены принимали кавернозную трансформацию, что выражалось в формировании гигантских, перерастянутых кровью сосудистых полостей, между которыми залегали узкие прослойки стромы. Стенки таких вен истончались, в них реже обнаруживались гладкие миоциты и эластические волокна, а чаще выявлялись коллагеновые фибриллы. «Зубчатообразные» вены имели большие размеры, а валики – атрофировались и замещались грубоволокнистой соединительной тканью. Медия артерий уменьшалась, просвет становился шире, а внутренняя эластическая мембрана растягивалась, по сравнению с артериями предыдущей серии. В мышечной оболочке артерии разрасталась грубоволокнистая соединительная ткань. Артерии замыкающего типа и мышечно-эластические сфинктеры не встречались. В редких пучках интимальной мускулатуры артерий наблюдалось развитие соединительной ткани. Морфометрическое исследование позволило установить, что внутренний диаметр артерий увеличивался в 1,3 (р<0,05) раза, а толщина уменьшалась в 1,1 (р<0,05) раза, по сравнению с компенсированным циррозом. Толщина интимы артерий уменьшалась в 1,2 (р<0,05) раза. Внутренний диаметр вен возрастал в 2 (р<0,05) раза, а толщина стенки уменьшалась – в 1,2 (р<0,05) раза, по сравнению со стадией компенсации. Количество артерий, имеющих интимальные пучки уменьшалось в 1,2 (р<0,05) раза.
В ходе исследования были сделаны следующие выводы: при алкогольном циррозе печени с развитием портальной гипертензии происходит переполнение кровью портокавальных венозных коллекторов в собственной пластинке и подслизистой основе нижней трети пищевода. Как показали наши исследования, в ответ на это развертывается ряд компенсаторных сосудистых реакций – «барьеров», препятствующих выраженному венозному застою и развитию кровотечения. Так, при перерастяжении кровью вен этого органа, «включается» реакция Бейлиса-Остроумова, выражающаяся в сокращение гладких миоцитов стенки этих сосудов с развитием их гипертрофии. Кроме того, в крупных венах происходит утолщение мышечных валиков, сокращение которых приводит к активному движению крови к сердцу. Одновременно с этим, при повышении давления в венозном русле наблюдается гипертрофия мышечной оболочки артерий и формирование продольного интимального слоя, располагающегося по всему периметру. Контракция гладких мышц средней оболочки и интимальных мыщц приводит к спазму, частичному или полному закрытию просвета артерии. Такие артерии получили название «замыкающих», а реакция – вено-артериальной. Сущность этой универсальной реакции заключается в том, что при венозной гипертензии рефлекторно происходит повышение сопротивления кровотоку и уменьшение притока крови. Параллельно с этим, в артериях появляется пучки интимальной мускулатуры и сфинктеры, функциональная роль которых заключается в регуляции нарушенного кровообращения и перераспределения потоков крови. Появление пучков и циркулярной продольной мускулатуры в интиме связывают с миграцией гладких миоцитов из медии в интиму через «окна» во внутренней эластической мембране при гемодинамических стимулах. Все эти сосудистые преобразования способствуют сглаживанию гемодинамических расстройств в пищеводе в условиях портальной гипертензии. В дальнейшем при нарастании венозного застоя прогрессирует хроническая гипоксия, способствующая развитию коллагеногенеза в стенках артерий и вен, мышечных валиках вен, интиме замыкающих артерий и пучках интимальных мышц. Поэтому склеротические изменения приводят к срыву реакции Бейлиса-Остроумова и вено-артериальной реакции, а также способности миогенных структур в регуляции нарушенного кровообращения, что, во многом, обусловливает ускорение венозного застоя, разрыву вен и развитию смертельного пищеводного кровотечения.


