Моделирование процесса синтеза метанола из углекислого газа
Журнал: Научный журнал «Студенческий форум» выпуск №20(156)
Рубрика: Химия

Научный журнал «Студенческий форум» выпуск №20(156)
Моделирование процесса синтеза метанола из углекислого газа
Влияние парникового эффекта на окружающую среду является мировой проблемой. Оно связано с огромными выбросами углекислого газа в атмосферу.
Существует несколько способов уменьшения выбросов диоксида углерода в атмосферу:
- переход от углеродных видов топлива к безуглеродным;
- улавливание и хранение диоксида углерода;
- переработка диоксида углерода до ценных веществ.
Конверсия углекислого газа рассматривается как дополнительный вариант к хорошо известным стратегиям улавливания, связывания и хранения для сокращения атмосферного CO2. Этот подход привлекателен в отношении стратегии, поскольку СО2 может быть преобразован в ценное химическое вещество. Таковыми являются диметиловый эфир, метанол и др. Среди имеющихся вариантов метанол является наиболее выгодным вариантом, который может быть получен в результате гидрирования CO2 и использован для использования как топливо или в качестве посредника в производстве других соединений [4].
В процессе гидрирования CO2 основными реакциями являются [2]:
Образование метанола:
СО2 + 3Н2 ⇆ СН3ОН + Н2О, DH298K = -49,5 кДж/моль (1)
СО + 2Н2 ⇆ СН3ОН. DH298K = -90,5 кДж/моль (2)
Побочной реакцией является реакция водяного газа:
CO2 + H2 ⇆ CO + H2O. DH298K = 41,19 кДж/моль (3)
Конверсия CO2 в полезные химические вещества может осуществляться гомогенными, гетерогенными и ферментативными каталитическими системами. Гомогенные катализаторы обычно обладают более высокой активностью, но гетерогенные катализаторы имеют то преимущество, что они проще с точки зрения конструкции реактора, разделения, обработки, стабильности и возможности повторного использования катализатора [1]. Поэтому было отдано предпочтение преобразованию CO2 в метанол с использованием гетерогенных катализаторов. В качестве катализаторов процесса в основном используются медносодержащие катализаторы.
Процесс синтеза моделируется как классический процесс синтеза метанола из синтез-газа. Однако в исследовании вместо обычного сырья принимается смесь углекислого газа и водорода. Используемым катализатором принимается разработанный китайскими учеными, волокнистый катализатор Cu/Zn/Al/Zr.
Моделирование проводится с использованием программы Aspen Plus V8.8. В качестве пакета свойств использовался пакет SRK (Soave-Redlich-Kwong). Метод свойств SRK позволяет моделировать процессы, в которых смесь неполярных (например, СО2) и полярных (такие как вода) соединений эксплуатируются при высоких температурах и давлениях, с высокой точностью.
В качестве реактора рассматривается изотермический трубчатый реактор синтеза метанола c неподвижным слоем катализатора, охлаждаемый внешним потоком воды. В модели реактора рассматриваются три основные реакции, протекающие при синтезе метанола. Эти реакции – гидрирование СО2, гидрирование СО и реакция водяного газа.
Рабочими температурой и давлением были определены как 250 оС и 5 МПа. Следующие скорости реакции для используемого катализатора применяются в качестве входных данных для реакторного блока: гидрирование СО2: 0.099, реакция водяного газа: 0.087 и гидрирования CO: 1. Таким образом, конверсия СО2 (за один проход) составляет 17,7 %, что практически соответствует в исследовании [1]. Разница зависит от выбора катализатора и оборудования, а также от другой оптимизации процесса. Весь монооксид углерода, образующийся в реакции водяного газа, гидрируется в следующей реакции, так как не должно быть образования СО в процессе.
Водород и углекислый газ вводятся в реактор в молярном соотношении H2:CO2 = 3:1, что соответствует литературным данным для получения эффективных коэффициентов конверсии [3]. На рисунке 1 приведена схема процесса синтеза метанола.
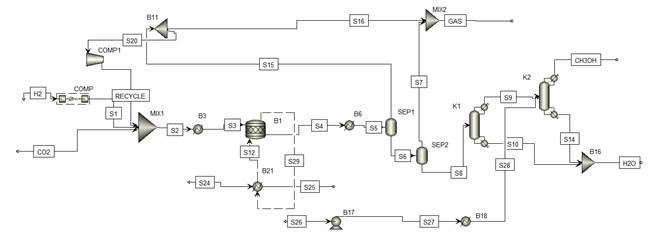
Рисунок 1. Схема процесса синтеза метанола
Далее в таблице 1 представлен материальный баланс процесса.
Таблица.
Материальный баланс процесса
|
Сырье |
Расход, т/ч |
Продукты |
Расход, т/ч |
|
СО2 |
39,72 |
СН3ОН |
21,25 |
|
Н2 |
5,07 |
Газ на продувку |
42,42 |
|
Вода на стрипинг |
30 |
Отработанная вода |
11,12 |
|
Итого |
74,79 |
Итого |
74,79 |
В результате исследования были определены зависимости выхода целевого продукта от режимных параметров, таких как температура и давление реактора, соотношение Н2:СО2 и объемная скорость подачи сырья (ОСПС).
Увеличение температуры процесса в реакторе увеличивает выход метанола, и максимальный выход составляет 17,7% при температуре 250 оС. Дальнейшее увеличение снижает выход продукта. Это связано с равновесием гидрирования СО2. Повышение давления также увеличивает выход метанола в процессе, однако оно ограничивается аппаратурным оформлением процесса. Соотношение Н2:СО2 также повышает выход продукта, однако ограничивается производительностью процесса и ОСПС. Повышение ОСПС снижает выход метанола при температуре 200 оС. Повышение ОСПС при температуре 250 оС до 10 ч-1 незначительно снижает выход метанола, однако дальнейшее повышение ОСПС приводит к сильному снижению выхода.
Были выявлены оптимальные параметры процесса – температура 250 оС, давление 5 МПа, соотношение Н2:СО2 = 3, ОСПС= 8 ч-1.

