Квантово-химическая оценка многокомпонентной реакции диакрбоновых кислот с аминами и альдегидами
Конференция: XXIV Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Математическая и квантовая химия

XXIV Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Квантово-химическая оценка многокомпонентной реакции диакрбоновых кислот с аминами и альдегидами
Аннотация. Проведены квантово-химические расчеты геометрии и энергии переходного состояния при образовании ключевых интермедиатов многокомопнентной реакции Кастаньоли-Кушмана с целью построения квантово-химической модели механизма. Результаты квантово-химических расчетов показывают, что многокомопнентная реакция Кастаньоли-Кушмана реализуется по механизму Манних-ацилирование.
Ключевые слова: многокомопнентная реакция Кастаньоли-Кушмана; квантово-химические расчеты.
Введение. Ранее сообщалось о протекании реакции между циклическими ангидридами дикарбоновых кислот и иминами, приводящей к получению полизамещенных γ и δ -лактамов [1]. Недавно были опубликованы результаты исследования протекания данной реакции в многокомпонентном формате [2], [3], [4]. Синтетические варианты успешной многокомпонентной реакции приведены на схеме 1.
Нами была осуществлена квантово-химическая оценка возможного механизма реакции. Механизм протекания реакции может осуществляться по двум ветвям: 1) ацилирование с последующим присоединением по Манниху, 2) Присоединение по Манниху, внутримолекулярное ацилирование.
Результаты и их обсуждение. С целью построения квантово-химической модели механизма многокомопнентной реакции Кастаньоли-Кушмана (МКРКК) нами были проведены квантово-химические расчеты геометрии и энергии переходного состояния при образовании ключевых интермедиатов. Модельные соединения, для которых проводили квантово-химические расчеты, представлены в таблице 1.

Схема 1. Примеры успешной реализации реакции Кастаньоли-Кушмана в многокомпонентном формате
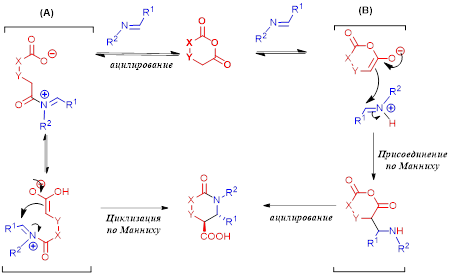
Схема 2. Предполагаемый механизм реакции Кастаньоли-Кушмана
Таблица 1.
Субстраты и промежуточные продукты МКРКК

Нами был построен энергетический профиль энергии НВМО при образовании переходного состояния (Рисунок 1).

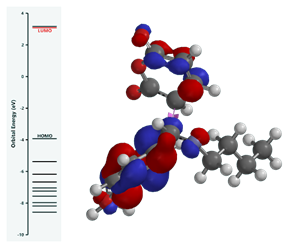
Рисунок 1. А – Энергетическое профиль переходного состояния стадии присоединения по Манниху, Б – геометрия переходного состояния
Результаты квантово-химического моделирования, показали, что стадия присоединения по Манниху характеризуется орбитальным контролем, промежутачная енольная форма ангидрида (который образуется in-situ) дополнительно стабилизируется π- электронным облаком фенильного заместителя. Геометрия переходного состояния характеризуется дополнительной стабилизацией связанной с π-π стэкинговым взаимодействием между фенильными заместителями глутаконовой кислоты и имина. В ходе квантово-химического моделирования переходного состояния стадии присоединения по Манниху нами было дополнительно обнаружено образование внитримолекулярной водородной связи. Данный факт может объяснить замедление скорости реакции внитримолекулярного ацилирования промежуточного продукта, что в совю очередь приводит к увеличению выхода изомерного продукта с мигрировавшей двойной связью (Схема 1 реакция 3)
Дополнительно нами было осуществлен квантово-химический расчет энергетического профиля при внутримолекулярном ацилировании (Рисунок 2).

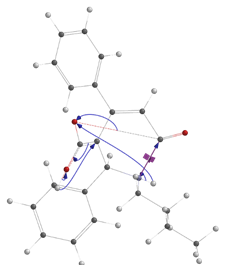
Рисунок 2. А - Энергетический профиль переходного состояния стадии внутримолекулярного ацилирования, Б - геометрия переходного состояния
Нами был дополнительно построен энергетический профиль реакции на основании результатов квантовохимических расчетов энергий исходных соединений, промежуточных продуктов и перходных состояний, который представлен на рисунке 3.
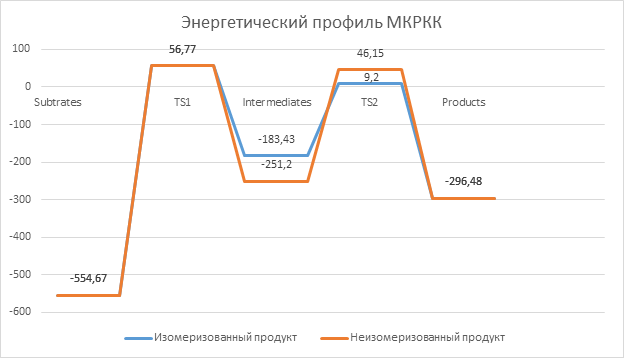
Рисунок 3. Энергетический профиль МКРКК
Полученная энергетическая диаграмма показывает, что в случае глутаконовых кислот при внутримолекулярном ацилировании существенный вклад в энергию переходного состояния вносит вклад внутримолекулярная водородная связь, что в свою очередь может объяснить образование изомеризованного продукта реакции.
Экспериментальная часть. В работе использовались реактивы фирмы “Sigma Aldrich”: 2-хлор-3-нитропиридин, 5-хлор-2-аминопиридин, 6-гидроксиникотиновая кислота, салициловая кислота, тиосалициловая кислота, салициламид, фениловый эфир салициловой кислоты, альдегиды различного строения R1(CO)R2, амины различного строения (HNR4аR4b), дикарбоновые кислоты различного строения R4(COOH)2, сульфохлориды различного строения R4SO2Cl, КДИ, ДЦК, палладий на угле 10%. Триэтиламин, о-дихлорбензол, этанол, пропанол-2, гексан, петролейный эфир, гидроксид натрия, нитрит натрия, карбонат калия, гидроксиламин солянокислый, сульфид натрия, аммиак водный, соляная кислота 36%, серная кислота, азотная кислота, хлорокись фосфора, хлористый тионил, – реактивы марки “ч” или “хч” отечественного производства. 1,4-Диоксан, ацетонитрил, ДМФА предварительно осушали по известным методикам и перегоняли.
Методики синтеза и идентификация полученных соединений. Цифровые обозначения синтезированных соединений соответствуют обозначениям, принятым в Химической части при описании объектов исследования. Чистоту полученных соединений контролировали методом тонкослойной хроматографии (ТСХ) на силикагеле на алюминевых пластинках Silufol 254 UV с использованием в зависимости от объектов различные элюенты. МС анализ высокого разрешения проводили на приборе Bruker microTOF, ионизация ESI, регистрация положительных ионов. Двухмерные корреляционные ЯМР спектры 1Н-1Н ЯМР NOESY и 1Н ЯМР спектры растворов образцов в ДМСО-d6 или в CDCl3 при 25 ºС записаны на приборе Bruker Avance III spectrometer (1H: 400.13 MHz; 13С: 100.61 MHz; химические сдвиги указаны в миллионных долях. ЯМР исследования проводили в научном парке Санкт-Петербургского Государственного Университета. Температуру плавления для полученных соединений измеряли с помощью прибора Stuart SMP50 в открытых стеклянных капиллярах. Аналитический ВЭЖХ анализ проводили с использованием хроматографа Милихром А-02 «Эконова», снабженного спектрофотометрическим детектором. Колонка: Eurospher 80-5 C18, 5 мкм, 8 см×5 мм. Элюирование в градиентном режиме: фаза А) 0.1% ТФУК в воде, фаза Б) 0.1% ТФУК в ацетонитриле. Градиент: 5−95% Б (0−15 мин), 95% Б (15−20 мин). Скорость потока 1 мл/мин, температура – 40 °C, детектирование по УФ поглощению при 254 и 380 нм. Объем инжекции образца 20мкл. Очистку полученных соединений с помощью препаративной ВЭЖХ осуществляли на хроматографе Shimadzu LC-20AP, снабженном спектрофотометрическим детектором. Колонка: Agilent Zorbax prepHT XDB-C18, 5 мкм, 21.2×150 мм. Элюент: А) 0.1% ТФУК в воде, Б) 0.1% ТФУК в ацетонитриле. Градиент: 20% Б (0 – 5 мин), 20 – 60% Б (0 – 20 мин), 60−90% Б (20 – 25 мин), 90% B (25 – 30 мин). Скорость потока 10 мл/мин, температура – 40 °C, детектирование по УФ поглощению при 254 и 380 nm. Объем инжекции образца 500 мкл.
Общий метод синтеза дигидропиридонов. В круглодонную одногорлую колбу, снабженную магнитной мешалкой, поместили суспензию соответствующей глутаконовой кислоты (1 ммоль) в 15 мл толуола и эквимолярные количества амина и альдегида. Реакционную смесь кипятили 16 ч в условиях азеотропной дегидратации. После охлаждения реакционной смеси толуол упарили при пониженном давлении, маслообразный остаток растворили в минимуме хлористого метилена и очищали с помощью колоночной хроматографии, элюент – гексан с градиентом ацетона от 0 до 25%. Фракции, содержащие целевой продукт, собирали, растворитель упаривали, остаток кристаллизовали из гексана.
Алгоритм квантовохимических расчетов. Квантово-химические расчеты выполнены с использованием программного обеспечения “SPARTAN 14”, с использованием методов semi-empirical в базисе pM3. Для расчета энергий основного состояния исходных соединений, промежуточных продуктов и полученных веществ предварительно проводили оптимизацию геометрии. Для расчета энергетического профиля реакции и переходного состояния проводили энергетическое профилирование 10 различных структур с измененной геометрией.
Выводы. В результате систематического исследования МКРКК нами было обнаружено, что реакция реализуется как тандемный процесс. Скорость образования имина превосходит скорость образования ангидрида во всех случаях. Чем и объясняется низкая скорость реакции. Однако образующийся ангидрид вступает в реакцию с имеющимся имином. Этим можно объяснить отсутствие амида как побочного продукта. Результаты квантово-химических расчетов показывают, что МКРКК реализуется по механизму Манних-ацилирование. Таким образом в МКРКК наиболее удачно удается вводить хорошо енолизующиеся альфа-СH кислоты. В случае тетрагидроизохинолоновых кислот для переходного состояния внутримолекулярного ацилирования характерна транс-конфигурация. Чем можно объяснить высокую диастереоселективность. Миграцию двойной связи в случае глутаконовых кислот можно объяснить возникновением внтуримолекулярно водородной связи между атомом азота интермедиата и гидроксигруппой енольной формы. Исходя из данных квантово-химического моделирования, можно сделать вывод, что МКРКК будут вступать винилоги и бензологи гомофталевой и глутаконовой кислот. Данные по моделированию показывают, что реакция чувствительна к заместителям в аминах и альдегидах (доноры предпочтительнее акцепторов), в тоже время заместители в гомофталевой и глутаконовой кислотах оказывают низкое влияние.

