МЕТАБОЛИЗМ ЖЕЛЕЗА В ОРГАНИЗМЕ ЧЕЛОВЕКА
Секция: Медицина и фармацевтика

LII Студенческая международная научно-практическая конференция «Естественные и медицинские науки. Студенческий научный форум»
МЕТАБОЛИЗМ ЖЕЛЕЗА В ОРГАНИЗМЕ ЧЕЛОВЕКА
Актуальность. Железо является неотъемлемой частью некоторых металлопротеинов, прежде всего гема. Железо необходимо для переноса кислорода, а также для переноса электронов и протекания каталитических реакций. Биологическая универсальность железа основана на его способности связываться с белками и действовать как донор и акцептор электронов. Таким образом, железо может легко преобразовываться между двумя своими обычными степенями окисления Fe 2+ (двухвалентное) и Fe 3+ (трехвалентное) за счет потери или приобретения одного электрона [4]. Химически реакционная способность железа имеет важное значение для его биологических свойств. Во-первых, Fe 2+ подвергается спонтанному аэробному окислению до Fe 3+, которое практически нерастворимо при физиологическом pH, что затрудняет усвоение железа клетками и организмами. Во-вторых, свободное железо действует как катализатор оксидативного стресса, что предполагает образование радикалов свободных форм кислорода, способных атаковать клеточные молекулы и вызывать повреждение тканей [3]. Следовательно, строгий контроль метаболизма железа необходим для удовлетворения метаболических потребностей в железе и предотвращения накопления токсичного избытка железа.
Гормональная регуляция системного гомеостаза железа гепсидином. Системный гомеостаз железа в первую очередь регулируется через ось гепсидин/ ферропортин. Гепсидин - это пептидный гормон, cинтезируемый печенью, который ограничивает транспорт железа в кровоток. Механизм его действия основан на связи с ферропортином в клетках-мишенях, в основном в макрофагах и энтероцитах, что способствует интернализации и деградации ферропортина. Первоначально гепсидин был идентифицирован как антимикробный пептид [1]. Его синтез в гепатоцитах включает стадию препептида, который подвергается протеолитическому процессингу до зрелого пептида, состоящего из 25 аминокислот с восемью остатками цистеина, образующие четыре дисульфидные связи. Хотя эти связи определяют укладку и структуру гепсидина, они, по-видимому, избыточны для регуляции железа, поскольку мини-гепсидин сохраняет ферропортин-связывающую активность и способствует деградации ферропортина в клетках. Гепсидин преимущественно продуцируется в печени гепатоцитами, но он также экспрессируется в макрофагах и клетках непеченочных тканей (таких как сердце, мозг, поджелудочная железа, желудок, легкие, почки, жировая ткань, сетчатка, но в них он выполняет тканеспецифические функции) [2].
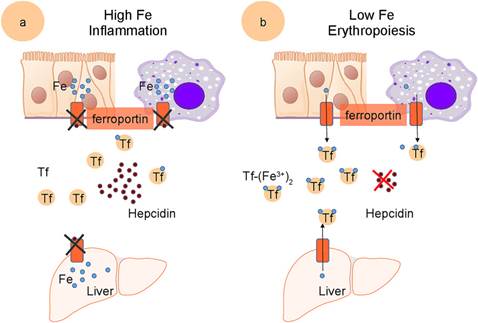
Рисунок. Гепсидин-опосредованная регуляция железа в кровотоке
(а) Гепсидин секретируется печенью в ответ на высокие уровни железа или воспалительные сигналы и связывается с ферропортином, запуская его деградацию; это приводит к задержке железа в энтероцитах и макрофагах.
(b) Экспрессия гепсидина подавляется в ответ на низкий уровень железа или высокий эритропоэз, что способствует абсорбции пищевого железа энтероцитами и высвобождению железа из макрофагов.
Экспрессия гепсидина регулируется в основном в ответ на поступление железа или воспаление. Железозависимая индукция гепсидина служит для предотвращения чрезмерного поглощения железа энтероцитами при повышении уровня железа в организме. Воспалительная индукция гепсидина способствует острому гипоферремическому ответу, который вызван задержкой железа в макрофагах. Считается, что это способствует защите организма при наличии инфекционного процесса [3]. Антимикробная активность гепсидина может усиливать защиту организма. Следует также отметить, что гепсидин способствует индукции транскрипции противовоспалительных генов и способствует разрешению воспаления. В совокупности эти данные подчеркивают, что гепсидин является важным молекулярным звеном между метаболизмом железа и врожденным иммунитетом.
Экспрессия гепсидина подавляется при анемии и гипоксии. Последующее накопление ферропортина в энтероцитах и макрофагах стимулирует отток железа в плазму, чтобы удовлетворить повышенные потребности в железе для эритропоэза. Гепсидин также регулируется другими вторичными положительными стимулами, такими как стресс эндоплазматического ретикулума или глюконеогенез; или отрицательными сигналами, такими как окислительный стресс, половые гормоны и факторы роста. Некоторые из этих реакций могут быть связаны с прогрессированием хронических заболеваний печени, но текущее понимание их физиологических последствий ограничено [3].
Нарушения регуляции гепсидина. Прорывом стало открытие, что дефицит гепсидина связан с наследственным гемохроматозом, аутосомно-рецессивным и генетически гетерогенным эндокринным заболеванием, связанным с перегрузкой железом. Таким образом, мутации гена гепсидина вызывают ювенильный гемохроматоз, редкую, раннюю форму гемохроматоза. Более того, умеренный дефицит гепсидина объясняет более легкие и более распространенные формы гемохроматоза. Признаками гемохроматоза являются гиперабсорбция пищевого железа (до 8–10 мг / день) и неспособность тканевых макрофагов удерживать железо, рециркулируемое во время эритрофагоцитоза. Эти ответы вызваны аберрантной сверхэкспрессией ферропортина в энтероцитах и макрофагах из-за несоответствующей супрессии гепсидина. Неограниченный отток железа из энтероцитов и макрофагов приводит к гиперферремии, высокому насыщению трансферрина. Железо легко усваивается гепатоцитами и другими паренхиматозными клетками и вызывает клинические осложнения (заболевания печени, диабет, кардиомиопатия, артрит, остеопороз). С другой стороны, избыточная экспрессия гепсидина связана с анемией. Наиболее неблагоприятный фенотип наблюдается при железорезистентной железодефицитной анемии, наследственном заболевании, вызываемом инактивирующими мутациями в гене TMPRSS6, кодирующем негативный регулятор гепсидина [3]. У пациентов с железорезистентной железодефицитной анемией развивается микроцитарная гипохромная анемия, которая не реагирует на пероральные добавки железа. При хронических воспалительных состояниях концентрация гепсидина приводит к гипоферемии из-за секвестрации железа в макрофагах. Это способствует развитию анемии воспаления, нормоцитарной нормохромной анемии, также известной как анемия хронического заболевания [2]. Гепсидин не является единственным фактором анемии хронического заболевания, которая является многофакторным состоянием, усугубляемое нарушением пролиферации эритроидных клеток-предшественников, усилением эритрофагоцитоза. Кроме того, удержанию клеточного железа способствует цитокин-опосредованная регуляция генов метаболизма железа - индукция транскрипции ферритина и подавление ферропортина [3].
Основные показатели обмена железа в организме. Основной белок метаболизма железа трансферрин осуществляет внеклеточный транспорт железа от мест его всасывания (в кишечнике) или освобождения (катаболизма эритроцитов в селезенке и печени) к местам нового использования, главным образом, к эритроидным предшественникам в костном мозге. С трансферрином сыворотки связаны 3 стандартных лабораторных показателя метаболизма железа: уровень сывороточного железа, общая железосвязывающая способность сыворотки и насыщение трансферрина железом. Показатель сывороточного железа отражает количество железа, транспортирующегося в данный момент к клеткам-потребителям. В основном, это железо, связанное с трансферрином. Однако в кровотоке может циркулировать и некоторое количество железа, связанного с другими белками плазмы, например, альбумином. Это, так называемое, нетрансферриновое связанное железо обладает способностью быстро, в нерегулируемой форме, диффундировать в клетки и проявлять токсические эффекты [5]. Содержание нетрансферринового связанного железа в плазме нарастает при развитии перегрузки железом, по мере заполнения железом всех свободных рецепторов трансферрина. Общая железосвязывающая способность сыворотки отражает резервную, незаполненные железом рецепторы трансферрина, и в норме составляет 50-70 ммоль/л. При перегрузке железом характерными лабораторными симптомами являются повышение сывороточного железа и снижение общей железосвязывающей способности сыворотки. В качестве дополнительной характеристики используется расчетный показатель насыщение трансферрина железом, который вычисляется по соотношению показателей сывороточного железа и общей железосвязывающей способности сыворотки. В норме он составляет от 20 до 40%. При перегрузке железом коэффициент насыщения трансферрина железом значительно превышает норму (> 50%) [5]. Утилизация железа, доставленного трансферрином к клеткам-потребителям, осуществляется с помощью специальных рецепторов, расположенных на поверхностной мембране клетки - трансферриновые рецепторы. Большая часть железа, поступившего в цитоплазму клетки («лабильный пул железа»), используется для синтеза гемоглобина, а в неэритроидных клетках – для синтеза ДНК, РНК и железосодержащих ферментов. Оставшаяся небольшая часть железа хранится внутриклеточно в безопасной и нетоксичной форме - в составе молекулы ферритина. Ферритин связывает 16-20% железа от его общего количества в организме и является преимущественно внутриклеточным белком, депонирующим железо и освобождающим его по мере необходимости [1]. В сыворотке крови здоровых людей содержится небольшое количество ферритина, основными источниками которого, предположительно, являются моноциты крови и макрофаги печени и селезенки. В физиологических условиях уровень сывороточного ферритина отражает запасы железа в организме: снижение сывороточного ферритина ≤ 40 мкг/л характерно для истинного железодефицита; повышение сывороточного ферритина > 1000 мкг/л – для первичных и вторичных гемохроматозов. При наличии очага воспаления или опухолевого роста повышение уровня сывороточного ферритина носит характер острофазового ответа. Помимо воспаления, гиперферритинемия может наблюдаться при массивном некрозе органов и тканей, когда в плазму крови освобождается значительное количество внутриклеточного ферритина. Таким образом, уровень сывороточного ферритина может служить показателем тканевых запасов железа только в отсутствии инфекционно-воспалительных, опухолевых и деструктивных процессов в организме. Ферропортин – транспортный белок, осуществляющий доставку (импорт) ионов пищевого железа в энтероциты двенадцатиперстной кишки. Ферропортин – единственный известный в настоящее время транспортный белок, осуществляющий выход (экспорт) двухвалентных ионов железа из клеток (энтероцитов, макрофагов, гепатоцитов) [4]. Гепсидин – низкомолекулярный белок, регулирующий внеклеточную концентрацию железа путем выключения функции ферропортина. Феррооксидазы (церулоплазмин, гефестин) – белки, осуществляющие перевод двухвалентных ионов железа в трехвалентные, что необходимо для связывания железа с трансферрином.





