Исследование процесса получения кальцинированной соды из гидросульфата натрия
Секция: Химия

LII Студенческая международная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
Исследование процесса получения кальцинированной соды из гидросульфата натрия
В настоящее время трудно себе представить какую-нибудь отрасль какой-либо страны, где бы не применялась сода или продукты из неё. Крупнейшими потребителями соды являются такие отрасли, как химическая, металлургическая, пищевая и другие.
В химической промышленности сода применяется для получения NaOH химическими методами, NaHCO3, соединений хрома, сульфитов и фторидов, фосфатов, NaNO2 и NaNO3, для очистки рассолов, а также используется для производства различных видов стекол.
Большое количество карбоната натрия используется в цветной металлургии: для производства глинозема, при переработке свинцово-цинковых, кобальт-никелевых, вольфрамомолибденовых руд.
Черная металлургия применяет Na2CO3 для удаления серы и фосфора из чугуна и извлечения ряда химических продуктов из смол в коксохимическом производстве.
В машиностроении содопродукты необходимы для пассивирования и обезвреживания деталей машин и инструмента. Кроме того, применяется сода и в литейном производстве.
Значительное количество соды используется в целлюлозно-бумажной промышленности для производства различных продуктов.
Медицинская промышленность использует соду в производстве различных медикаментов. Следует указать на применение соды в изготовлении электровакуумного стекла в электронной промышленности.
Большое значение имеет использование соды для очистки различных сточных вод, очистки воды питающей паровые котлы.
В легкой промышленности кальцинированная сода используется для беления и крашения тканей, получения искусственного щелка, нитроцеллюлозы.
Большое значение имеет применение соды для производства мыла и моющих средств, без которых современная жизнь кажется невозможной [1–3].
В Республике Казахстан производство кальцинированной соды, в которой так нуждаются многие отрасли, отсутствует.
Имеются месторождения поваренной соли и известняка - исходного сырья для производства кальцинированной соды - в Кызылординской, Жамбылской, Павлодарской и Алматинской областях.
В Казахстане число известных солевых озер превосходит 2500 ед. Как видно из приведенных данных Республика Казахстан располагает большими и богатыми месторождениями природного сульфата и хлорида натрия в виде твердых отложений, paпы соляных озер.
Запасы исчисляются миллиардами тонн, которые могут быть использованы для получения как чистого сульфата натрия, так и для получения кальцинированной соды.
В связи с чем в Жамбылской области рассматривается возможность производства кальцинированной соды. Необходимость строительства завода продиктована необходимостью обеспечить кальцинированной содой химические предприятия Жамбылского региона, в частности, ТОО «КазФосфат», которое закупает этот продукт в России.
Хлорид натрия можно использовать для получения гидросульфата натрия, который в дальнейшем можно использовать для получения кальцинированной соды.
Процесс получения кальцинированной соды из гидросульфата натрия основан на реакции взаимодействия гидросульфата натрия с гидрокарбонатом аммония с последующей кальцинацией гидрокарбоната натрия.
NaHSO4 + 2NН4НCO3 = NaHCO3 + (NН4)2SО4 + CO2 + H2O (1)
2NaHCO3 = Na2CO3 + CO2 + H2O (2)
В растворе гидрокарбоната натрия также может присутствовать определенное количество сульфата натрия, который также взаимодействует с гидрокарбонатом аммония по реакции:
Na2SO4 + 2NH4НCO3 = 2NaHCO3 + (NH4)2S04 (3)
С целью подтверждения возможности протекания этих реакций (1,2,3) были рассчитаны изменения энергии Гиббса при различных температурах. Результаты расчета приведены в таблице 1.
Таблица 1.
Изменения энергии Гиббса (∆GT) от температуры процесса
|
Реакции |
Температура, К |
∆G, Дж/моль |
|
NaHSO4+2NН4HCO3=NaHCO3+(NН4)2SО4+ +CO2 +H2O
|
298 333 353 |
-924861 -942361 -153000 |
|
Na2SO4+2NH4НCO3= NaHCO3+(NH4)2SО4 |
298 333 353 |
-170671 -1706873 -1707009 |
|
NaHCO3= Na2CO3+CO2 +H2O |
373 453 490 |
2786,4 -17432 -37603 |
Как видно из таблицы в реакциях взаимодействия гидросульфата натрия и сульфата натрия с гидрокарбонатом аммония изменения энергии Гиббса при температурах 25, 60 и 80°С имеют отрицательное значения, что подтверждает о возможности протекания процесса получения гидрокарбоната натрия. Реакция кальцинации гидрокарбоната натрия при температуре 100°С не протекает т.к. ∆G>O, а при температурах 180, 220°С процесс кальцинации протекает.
Исследования были проведены в термостатированной установке в интервале температур 25-55°С и времени 1- 6 часов. По окончания опыта гидрокарбонат натрия отфильтровывали и осадок промывали насыщенным раствором соды в соотношении Т : Ж=1: 3. Осадок и фильтрат анализировали на содержание Na+, NH3 , СО2 и SO4-2. Результаты анализа приведены в таблице 2.
Таблица 2.
Химический состав твердой и жидкой фазы
|
Наименование |
Состав, % |
||||
|
Na+ |
SO42- |
NН3 |
CO2 |
H2O |
|
|
1.Фильтрат 2.Осадок 3.Промывная вода |
3,14 22,1 2,67 |
28,15 0,16 9,8 |
10,35 1,7 5,02 |
4,59 44,2 5,78 |
53,27 31,83 76,63 |
Из данных таблицы 2 видно, что содержание Na+ - 22,1%, CO2 - 44,2%. Это свидетельствует об образовании гидрокарбоната натрия. Содержание 3,14% иона натрия в фильтрате показывает на наличие гидросульфата не провзаимодействовавшегося с карбонатом аммония, что также подтверждается содержанием большого количества иона SO42- в фильтрате. Основное количество SO42-связываясь с NН4 + образует сульфат аммония.
Наряду с этим были исследованы влияние продолжительности процесса, температуры на степень использование натрия остаточного содержания SO42- иона. Результаты представлены в таблицах 3, 4.
По полученным данным были построены графики зависимости степени использования натрия от продолжительности процесса при различных температурах (рис.1) и зависимости остаточного содержания S042- от продолжительности процесса при температуре 35оС (рис.2).
Из рисунка 1 видно, что степень перехода натрия в кальцинированную соду с увеличением времени возрастает. Одновременно на степень перехода натрия в карбонат натрия влияет и температура процесса. В интервале температур 30-45°С в течение 1,0 часа степень перехода натрия в кальцинированную соду составляет 54,1% и 55,6%, а в течение 5,0 часов степень перехода возрастает до 59,6-63,2%. Дальнейшее увеличение времени практически не влияет на степень перехода натрия и остается постоянной.
Таблица 3.
Зависимость степени использования натрия от продолжительности процесса при различных температурах
|
Продолжительность процесса, час. |
Степень использования натрия, % |
|||
|
30°С |
35°С |
45°С |
55°С |
|
|
1 |
54,3 |
55,6 |
55,7 |
55,9 |
|
2 |
57,8 |
58,3 |
59,2 |
60,0 |
|
3 |
60,1 |
61,2 |
61,8 |
62,3 |
|
4 |
61,2 |
62,1 |
62,7 |
63 |
|
5 |
61,9 |
62,8 |
63,0 |
63,2 |
|
6 |
61,8 |
62,8 |
63,2 |
63,2 |
Таблица 4.
Зависимость остаточного содержания SO42- иона от продолжительности процесса при температуре 35°С
|
Продолжительность |
1 |
2 |
3 |
4 |
5 |
6 |
|
Остаточное содержание SO42- в осадке |
1,5 |
0,68 |
0,43 |
0,29 |
0,19 |
0,15 |
Следует отметить, что в начальных стадиях скорость протекания процесса, т.е. взаимодействия гидросульфата натрия с гидрокарбонатом медленнее, чем при 45-55°С. Для этих температур скорость отличается незначительно. Оптимальные значение достигают при температуре 35 и 45°С и времени 5 часов. В этих условиях общая степень перехода натрия в карбонат натрия достигается до 63,2%.
На качество продукта влияет остаточное содержание в ней сульфата натрия и аммония.
Поэтому остаточное содержание SO42- иона в осадке должно быть минимальным. Остаточное содержание SO4-2 условиях по мере протекания процесса снижается от 1,0% до 0,15%, что характерно для кривых изменения, представленных на рисунке 1. Минимальное содержание SO4-2. в осадке вполне удовлетворяет требованиям состава продукта кальцинированной соды.

Рисунок 1. Зависимость степени использования натрия (%) от времени
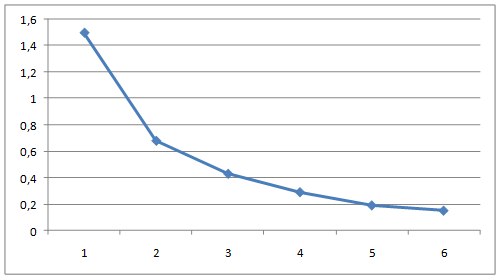
Рисунок 2. Зависимость остаточного содержания S042- от продолжительности процесса при температуре 35оС
Реакция взаимодействия гидросульфата натрия и гидрокарбоната аммония является обменной реакцией и протекает очень быстро. Увеличение продолжительности процесса до 5 часов показывает, что процесс протекает в диффузионной области через поверхности образовавшейся части NaHCO3 . Для интенсификации процесса необходимо не только увеличение времени, но и скорости перемешивания раствора.
Анализ литературных источников свидетельствует о перспективности получения кальцинированной соды из природных солей Республики Казахстан.
Учитывая недостатки существующих на данный момент методов технологии получения кальцинированной и запасы природных натрийсодержащих солей, необходима разработка безотходной, экономически выгодной технологии, которая позволяет получать продукты, отвечающие международным стандартам.
В представленной работе расчетами изменения энергии Гиббса при различных температурах, установлена возможность протекания реакций взаимодействия гидросульфата натрия и сульфата натрия с гидрокарбонатом аммония, а также процесса кальцинации гидрокарбоната натрия.
В лабораторных условиях исследован процесс получения кальцинированной соды из гидросульфата натрия, основанный на реакции взаимодействия гидросульфата натрия с гидрокарбонатом аммония с последующей кальцинацией гидрокарбоната натрия[4].
Установлено, что степень перехода натрия в кальцинированную соду с увеличением времени возрастает.
Одновременно на степень перехода натрия в карбонат натрия влияет и температура процесса.
В интервале температур 30-45°С в течение 1,0 часа степень перехода натрия в кальцинированную соду составляет 54,1% и 55,6%, а в течение 5,0 часов степень перехода возрастает до 59,6-63,2%. Дальнейшее увеличение времени практически не влияет на степень перехода натрия и остается постоянной.
В начальных стадиях скорость протекания процесса, т.е. взаимодействия гидросульфата натрия с гидрокарбонатом медленнее, чем при 45-55°С.
Для этих температур скорость отличается незначительно. Оптимальные значение достигают при температуре 35 и 45°С и времени 5 часов. В этих условиях общая степень перехода натрия в карбонат натрия достигается до 63,2%.
Для интенсификации реакции взаимодействия гидросульфата натрия и гидрокарбоната аммония необходимо не только увеличение времени, но и скорости перемешивания раствора .





