Анализ взаимодействия генов-онкосупрессоров (RB, ING1, ТР53) при онкопатологии
Секция: Биология

XL Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
Анализ взаимодействия генов-онкосупрессоров (RB, ING1, ТР53) при онкопатологии
Охарактеризовано распределение частот аллелей и генотипов по полиморфным локусам rs1042522(G/C) гена опухолевого белка 53, rs137853294(С/G) гена ретинобластомы и rs121909250 (С/G) гена ингибитора опухолевого роста в выборке здоровых и онкобольных. Выявлены сочетания генов, повышающие риск возникновения онкопатологии. Частоты встречаемости аллельного варианта *G гена ТР53, аллельных вариантов *C и *G гена ING1, аллельного варианта *G гена RВ различаются в группе больных и группе контроля.
ВВЕДЕНИЕ В настоящее время онкологические заболевания являются одной из основных проблем здравоохранения. Так в России более 2.5 миллионов людей состоят на учете в онкологических медицинских учреждениях, и ежегодно на учет встает около 190 тысяч человек.
Раковые опухоли – это скопления интенсивно делящихся клеток. Одной из основных особенностей раковых клеток является их относительная автономность, способность к неограниченному числу делений и метастазированию. Раковые клетки не подчиняются контрольным механизмам, регулирующим жизнедеятельность нормальных клеток [2; 3; 4].
В основе канцерогенеза, вне зависимости от опухолевой локализации, лежит злокачественная трансформация клетки при нарушении контроля клеточного цикла и угнетения апоптоза [4]. Молекулярный патогенез онкологических заболеваний включает множество генетических и эпигенетических событий, ведущих к активации онкогенов и инактивации генов опухолевой супрессии [2; 3].
К одним из ключевых генов-супрессоров опухолевого роста относят гены RB, ING1, ТР53 входящих в один каскад, регулирующих работу друг жруга. Белковые продукты данных генов осуществляют реализацию широкого спектра клеточных процессов, регуляцию клеточного цикла, индукцию апоптоза, постоянный надзор за состоянием генома и злокачественной трансформацией клеток. Ген RB также является одной из мишеней трансактивационного действия гена ТР53, а следовательно, и супрессоров, участвующих регуляции активности/стабильности ТР53 и ING1. Изменение их функциональной активности ведет к накоплению повреждений ДНК и увеличению вероятности злокачественного перерождения клетки [3].
Ген ретинобластомы (RB) локализован на длинном плече 13 хромосомы - 13q14.1, и имеет протяженность в 180 т.п.н. геномной ДНК [9]. В норме он кодирует ядерный белок, фосфорилирование которого приводит к переходу клеток из G1-фазы в S-фазу и началу нового цикла репликации [16]. Инактивация или отсутствие RB-белка могут быть связаны с неконтролируемым размножением опухолевых клеток [9]. Трансверсия rs137853294 (С/G) в 20 экзоне гена RB приводит к замене аргинина на триптофан в положении 661. В ряде исследований показано, что аллель *С кодирует значительно более эффективный белковый продукт, запускающий программированную клеточную смерть [5].
Ген ING1 локализован на длинном плече 13 хромососы (13q34). Опухолевый ингибитор ING1 кодирует белок-супрессор опухолей, который может индуцировать остановку роста клеток и апоптоз. Трансверсия rs121909250 во 2 экзоне гена ING1 приводит к замене цистеина на серин в 215 положении. Эта замена может привести к разрыву 3-мерной структуры белка и нарушению функции. Белок, кодируемый аллелем *G индуцирует клеточный цикл в G1/S - контрольном пункте клеточного цикла. [16; 7].
Ген TP53 у человека локализован на коротком плече 17 хромосомы – 17р13, имеет размер в 20 кб, и состоит из 11 экзонов [12,13]. TP53 – транскрипционный фактор, ядерный белок, кодируемый одноименным геном-онкосупрессором, регулирует митотический цикл, дифференцировку клеток и их гибель при апоптозе [13]. Полиморфизм rs1042522 в гене TP53 обусловлен заменой цитозина на глицин в 72 кодоне. Обнаружено, что эффективность апоптоза выше у лиц с гомозиготной формой аллелей Arg/Arg, тогда как Pro/Prо форма индуцирует клеточный цикл в G1-фазе, определяя тем самым клеточную пролиферацию [12].
Цель настоящего исследования заключается в анализе взаимодействия различных аллельных состояний генов, которые запускают ключевые механизмы при канцерогенезе клетки.
Выборка исследования была сформирована из 562 человек проживающих в Республике Башкортостан. Из них 312 больных, находившихся на стационарном лечении в ГБУЗ «Республиканский клинический онкологический диспансер» МЗ Республики Башкортостан, и 250 здоровых индивидов, носителей нормальных аллелей полиморфных локусов rs1625895 (G/A), DUP16ВР гена ТР53, так как «рисковые» аллели гена ТР53 обнаруживаются с частотой от 50 до 86% при различных онкопатологиях [1]. Анкетирование и сбор венозной крови для проведения генетических исследований проводилось с согласия исследуемых людей.
Образцы геномной ДНК были выделены из 8 мл цельной венозной крови методом фенольно-хлороформной экстракции [10]. Типирование образцов проводили путем полимеразной цепной реакции (ПЦР) с использованием олигонуклеотидных праймеров, специфичных к участку гена RB rs137853294 (F:tgggggaaagaaaagagtggtagaa, R: gaggagagaaggtgaagtgcttg), гена ING1 rs121909250 (F: gcagccccagtcactcac, R: ctgcggtgtggttggttct), гена TP53 rs1042522 (F:ttgccgtcccaagcaatggatga, R:tctgggaagggacagaagatgac).
Размеры продуктов амплификации и последующей рестрикции детектировали в 7% полиакриламидном геле. Окрашивание гелей проводили раствором этидия бромида (1%), последующую визуализацию с помощью видеогель-документирующей системы (Gel Imager). Для определения статистических параметров использовались программы MS Excel и Statistica 6.0., анализ сцепления проводили с использованием программы 2 LD (Zapata C, 2001), гаплотипический анализ – с помощью программы EH (Xiex, 1993). Различия между параметрами считались статистически достоверными при p<0,05. Межгенное взаимодействие локусов типированных генов оценивали с помощью программы Multifactor Dimensionality Reduction 2.0 (MDR 2.0), основанной на методе логистической регрессии (Moore et al., 2006).
При анализе полиморфного локуса rs137853294 гена RВ (табл.1) было выявлено 2 аллеля и 3 генотипа как в группе больных, так и в группе контроля. В группе онкобольных показано достоверно значимое повышение гомозиготного генотипа *G/*G за счет достоверного снижения частоты гетерозиготного генотипа *С/*G (p=0,0005). Повышение частоты генотипа *G/*G у онкобольных возможно связано с тем, что происходит снижение способности к взаимодействию и активации транскрипции генов-мишеней, а также низкой эффективностью апоптозa [5; 15].
Анализ распределения частот генотипов и аллелей полиморфного локуса rs121909250 в гене ING1 выявил 2 аллеля и 3 генотипа как в группе больных, так и в группе контроля. Была установлена следующая закономерность при распределении частот генотипов (табл.1): было выявлено достоверно значимое частоты гомозиготного генотипа *G/*G и аллеля *G (p=0,0005) у онкобольных. Также отмечено увеличение частоты встречаемости гетерозигот в группе здоровых лиц, что позволяет предполагать о протективное действие *С/*G – генотипа гена ING1 в отношении развития онкологии.
Анализ распределения частот генотипов и аллелей полиморфного локуса rs1042522 гена ТР53 выявил 2 аллеля и 3 генотипа в группе больных, и 1 аллель и 1 генотип в группе контроля. При сравнительном анализе было выявлено достоверно значимое увеличение частоты гомозиготного генотипа *С/*С и гетерозиготного генотипа *G/*С в группе онкобольных.
Таблица 2.
Распределение частот генотипов и аллелей генов RВ (rs137853294), ING1 (rs121909250), ТР53 (rs1042522)
|
Генотип, аллель |
Группа контроля (pi±sp) |
Онкобольные (pi±sp) |
p, c2 |
|
rs137853294 (С/G) гена RВ *C/*C *C/*G *G/*G *C *G |
0,01±0,06 0,78±0,02 0,19±0,02 0,4±0,02 0,6±0,02 |
0,04±0,01 0,54±0,02 0,42±0,02 0,31±0,02 0,69±0,02 |
0.095 (2.79) 0.0005 (52.34) 0.0005 (26.02) 0.004 (8.48) 0.004 (8.48) |
|
rs121909250 (C/G) гена ING1 *C/*C *C/*G *G/*G *C *G |
0,29±0,02 0,66±0,02 0,05±0,01 0,62±0,02 0,38±0,02 |
0,42±0,02 0,35±0,02 0,22±0,02 0,6±0,02 0,4±0,02 |
0.0005 (35.86) 0.0005 (71.36) 0.0006 (16.12) 0.016 (1.92) 0.016 (1.92) |
|
rs1042522 (G/C) гена ТР53 *G/*G *G/*C *C/*C *G *C |
1±0,01 0±0,01 0±0,01 1±0,01 0±0,01 |
0,46±0,02 0,39±0,02 0,14±0,02 0,66±0,02 0,34±0,02 |
0.0005(245.79) 0.0005(162.86) 0.0005(50.67) 0.0005(275.86) 0.0005(275.86) |
Примечание:* χ2- критерий хи-квадрат, р-вероятность
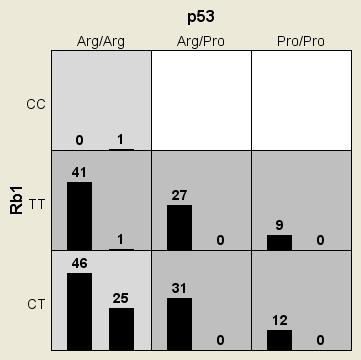
С помощью программы MDR 2.0 была определена двухлокусная модель взаимодействия ДНК-локусов, повышающая риск развития онкопатологии: генов RВ (rs137853294) и ТР53 (rs1042522) с воспроизводимостью 70% (Cross-Validation Consistency). Тестируемая сбалансированная точность (Bal.Acc.) данной модели составила 0,82, чувствительность (Se) – 0,72, повторяемость результата (CV Consistency) – 10/10, p < 0,0001. К сочетаниям повышенного риска развития заболевания были отнесены 5 сочетаний генотипов, наиболее значимая из них RB TT/TP53 Arg/Arg. На рисунке 1А представлено распределение комбинаций полиморфных локусов генов RВ и ТР53.
 А
А 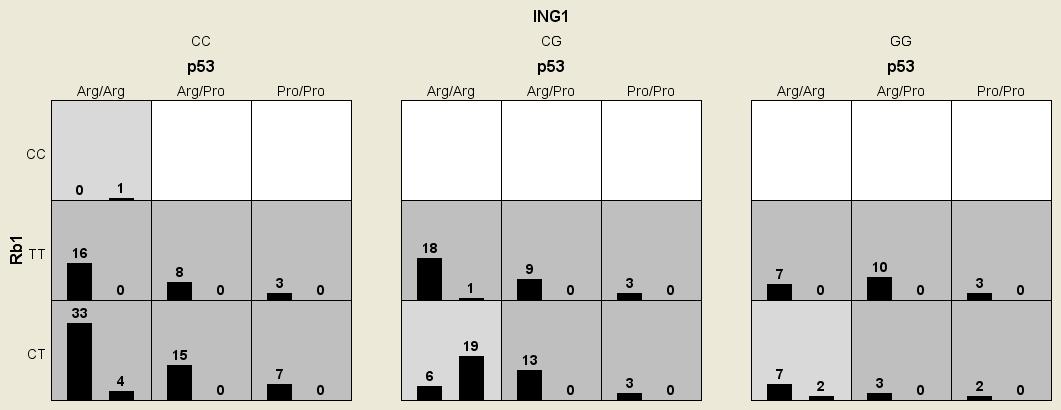 Б
Б
Рисунок 1. Распределение частот двухлокусного и трехлокусного сочетаний генотипов генов RВ, ТР53 и ING1:А) гистограмма сочетаний генотипов генов RВ, ТР53; Б) гистограмма сочетаний генотипов генов RВ, ТР53, ING1. Примечание. Темно-серые ячейки – генотипы повышенного риска, светло-серые ячейки – генотипы пониженного риска, белые ячейки – отсутствуют сочетания генотипов (левые столбики в ячейках – больные, правые – здоровые индивиды)
Установлена статистически значимая трехлокусная модель взаимодействия генов RВ (rs137853294), ТР53 (rs1042522), ING1 (rs121909250) (рис.1Б). Тестируемая сбалансированная точность (Bal. Acc.) данной модели составила 0,84, чувствительность (Se) – 0,9, повторяемость результата (CV Consistency) – 10/10. Как следует из гистограммы, наибольшее различие было установлено для комбинации генотипов CT гена RВ, Arg/Arg гена ТР53, CC гена ING1, и только среди больных встречались варианты: TT гена RВ, Arg/Arg гена ТР53, CC гена ING1; CT гена RВ, Arg/Pro гена ТР53, CC гена ING1; CT гена RВ, Arg/Pro гена ТР53, CG гена ING1.
В связи с тем, что белки RB и ING1 кодируются генами, локализованными на одном плече хромосомы 13 (13q14.1 и 13q34 соответственно) был проведен анализ сцепления. Согласно National Center for Biotechnology Information (www.ncbi.nlm.nih.gov), физическое расстояние между генами составляет 62230733 п.н., что соответствует 62 Mb или 62 сМ. Анализ неравновесия по сцеплению (в программе 2LD) не выявил сцепления между локусами гена RB (rs137853294) и ING1 (rs121909250) (D'=0,15). В группе онкобольных определено слабое сцепление между этими генами, D'-коэффициент которых составил 0,36.
В результате анализа гаплотипов (программа ЕН) было выявлено, что в группе здоровых индивидов достоверно чаще встречается гаплотип *C(RB)/*С(ING1) (р=0,006), сочетающий только протективные аллели (рис.2). У онкобольных преобладает гаплотип *G(RB)/*G(ING1), сочетающий только рисковые аллели (р=0,0005) по полиморфным локусам генов RB (rs137853294) и ING1 (rs121909250) соответственно.
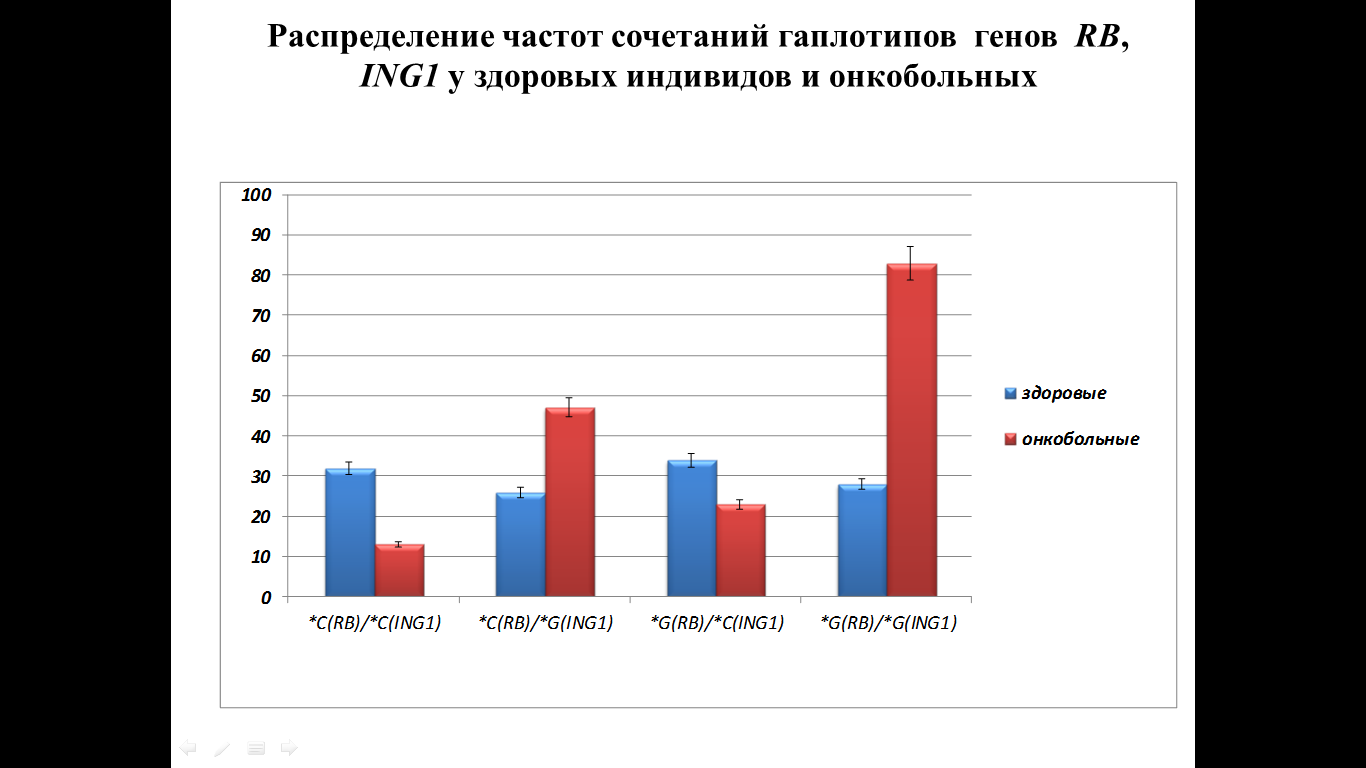
Рисунок 2. Распределение частот гаплотипов аллелей генов RB и ING1
ЗАКЛЮЧЕНИЕ
Клеточный цикл сложно регулируемая система, нарушения в которой ведут к злокачественной трансформации клетки и развитию опухоли. Существуют механизмы генетической регуляции клеточного цикла, свойственные любым клеткам, независимо от их специализации. В исследовании изучена роль генов системы онкосупрессии RB, ING1, TP53 как внутренних факторов риска злокачественной трансформации клетки. Одновременная модификация этих белков может привести к срыву механизмов контроля в регуляции клеточного цикла.
У онкобольных выявлено достоверное повышение частоты генотипа *G/*G и аллеля *G гена RB, а также генотипа *G/*G гена ING1 в группе больных. Это в свою очередь подтверждает ключевую роль аллельного состояния генов системы онкосупрессии в формировании риска злокачественной трансформации клетки.
Список литературы:
- Ганцев Ш.Х., Горбунова В.Ю., Галикеева Г.Ф., Воробьева Е.В., Васильева Э.М., Рустамханов Р.А. Функционирование генов онкосупрессии (ТР53, BRCA1) и их взаимодействие с цитокинами при раке молочной железы // Креативная онкология и хирургия. 2012. №2. С.
- Залетаев Д.В., Немцова М.В., Стрельников В. Диагностика эпигенетической патологии при наследственных и онкологических заболеваниях // Молекулярная биология. 2004. Т. 38. С. 213–223
- Копнин Б.П. Мишени действия онкогенов и опухолевых супрессоров: ключ к пониманию базовых механизмов канцерогенеза. // Биохимия. 2000. T.65 C. 5–33
- Татосян А.Г. Онкогены – Сборник обзорных статей «Канцерогенез», под ред. Д.Г. Заридзе // – М: Научн. Мир. 2000. С. 57–74.
- Dietmar R. Lohmann, Martin Gerick, Birgit Brandt, Ulrich OelschlAger, Birgit Lorenz. Constitutional RB1 – Gene Mutations in Patients with Isolated Unilateral Retinoblastoma. // Am. J. Hum. Genet. 1997. T.61 P.282–294
- Dumont P., Leu J.I., Della Pietra A.C. et al. The codon 72 polymorphic variants of p53 have markedly different apoptotic potential // Nat. Genet. 2003. V. 33 (3). P.357–365.
- Garkavtsev I, Boucher Y. An intact ING1-P53 pathway can potentiate the cytotoxic effects of taxol. // Cancer Biol Ther. 2005. V.4 P.48–49.
- Garkavtsev I, Riabowol K. Extension of the replicative life span of human diploid fibroblasts by inhibition of the p33ING1 candidate tumor suppressor. // Mol Cell Biol. 1997. V. 17 P.2014–2019.
- Knudson A.G. Jr. «Mutation and cancer: statistical study of retinoblastoma», // rocNatlAcadSci U S A. 1971. V.68. P.820–823.
- Mathew C. The isolation of high molecular weight eucariotic DNA. Methods in Molecular Biology // Ed. Walker J.M.N. Y. Human Press. 1984. V. 2. P. 31–34.
- Miki Y., Swensen J., Shattuck-Eidens D., Futreal P., Harshman K., Tavtigian S., Liu Q., Cochran C., Bennett L., Ding W. A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1 // Science. 1994. V. 266. P. 66–71.
- Miller C., Mohandas T., Wolf D., Prokocimer M., Rotter V., Koeffler H. Human p53 gene localized to short arm of chromosome 17 // Nature. 1986. V.319. P.783–784.
- Moore J.H. et al. A fl exible computational framework for detecting, characterizing, and interpreting statistical patterns of epistasis in genetic studies of human disease susceptibility // J. Theoretical Biology. 2006. Nо. 241. P. 252–261.
- Soussi T., Fromentel C., May P. // Oncogene. 1990. V.5. P.945–952.
- Vogelstein B., Kinzler K.W. // Cell, 1992. V.70.P. 523–526.
- Wei Du and Jennifer S. Searle “The Rb Pathway and Cancer Therape” //Article in Current drug targets. 2009. V. 10(7): 581–9.
- Wijnhoven SW, Hoogervorst EM, de Waard H, van der Horst GT, van Steeg H. “Tissue specific mutagenic and carcinogenic responses in NER defective mouse models”. Mutat Res. 2007. V.614. Р.77–94.





