Создание фармацевтической композиции для лечения заболеваний желудочно-кишечного тракта без кислотостойкой оболочки
Секция: Медицина и фармацевтика

XLIV Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
Создание фармацевтической композиции для лечения заболеваний желудочно-кишечного тракта без кислотостойкой оболочки
В современной медицине широко применяются лекарственные препараты, имеющие ферментную природу. Из множества известных ферментов микробного происхождения практическое применение в медицине и различных отраслях промышленности нашли гидролитические ферменты, продуцентом которых является Bacillus subtilis.
Основным источником ферментов медицинского назначения остается как животное, так и микробное сырье. Однако ограничение животного сырья не позволяет полностью удовлетворить потребности практической медицины. Поэтому в роли недорогих источников ферментов применяют микроорганизмы. Все ферментные препараты для лечения заболеваний желудочно-кишечного тракта (ЖКТ), существующие на сегодняшний день, выпускаются в виде таблеток или капсул с кислотостойкой оболочкой. Наличие этой оболочки затрудняет применение лекарств, т.к. нет возможности использовать лекарство для лечения грудных детей, для больных, которые не способны глотать таблетки или капсулы, такие препараты не могут быть разделены на части при дозировании без потери активности. Эти недостатки могут быть устранены при использовании метода обратимой сорбционной иммобилизации лекарственных веществ на специально подобранном мелкодисперсном носителе. Поэтому задачей работы является получение фармацевтической композиции в виде суспензий, порошкообразной формы или легко распадающихся таблеток.
Объектом исследования является гидролитический фермент протеаза, продуцируемая Bacillus subtilis. Сырьем для получения протеазы, которая может быть использована в качестве лечебного препарата, является технический ферментный препарат протосубтилин Г3х производства Сиббиофарм (Россия), который предварительно был очищен. В качестве носителей для создания обратимо-диссоциирующего комплекса протеазы были выбраны карбоксильный катионит Биокарб А и сульфокатионит КУ-23.
Концентрация общего белка в растворе определяется по методу Лоури с использованием реактива Фолина[1]. Протеолитическая активность – методом Кунитца[5], где за одну протеолитическую единицу принимают такое количество препарата, при воздействии которого на субстрат в течение 10 минут в стандартных условиях освобождается такое количество продуктов гидролиза, которое приводит к возрастанию оптической плотности при длине волны 280 нм на одну единицу.
Для проведения экспериментов по определению зависимости емкости сорбции от pH раствора навеску сорбента уравновешивали ацетатными буферными растворами с рН=3,5; 4,0; 5,0; 6,0 и боратными буферами с рН=7,0; 8,0 и 9,0. После уравновешивания буферный раствор декантировали и навеску заливали исследуемым раствором. Сорбцию проводили в статических условиях при постоянном перемешивании на настольном шейкере CERTOMAT MO II [4]  при постоянной температуре 24
при постоянной температуре 24  . Сорбцию проводили в течение 2 часов. После окончания процесса сорбции измеряли концентрации общего белка и ферментативную активность как в исходном, так и в равновесных растворах. Рассчитывали емкость сорбции. По экспериментальным данным, после статистической обработки данных, была построена зависимость в координатах mсорб(рН). График представлен на рисунке 1.
. Сорбцию проводили в течение 2 часов. После окончания процесса сорбции измеряли концентрации общего белка и ферментативную активность как в исходном, так и в равновесных растворах. Рассчитывали емкость сорбции. По экспериментальным данным, после статистической обработки данных, была построена зависимость в координатах mсорб(рН). График представлен на рисунке 1.

Рисунок 1. Зависимость емкости сорбции от рН раствора
Из графика видно, что для карбоксильных катионитов кривая имеет колоколообразную форму с максимумом сорбционной емкости для протеазы при рН=6. Так как сильнокислотный катионит КУ-23 диссоциирует на всем диапазоне рН, по всей вероятности, он не будет защищать фермент при прохождении среды желудка. Несмотря на то, что емкость сульфокатионита КУ-23 больше, чем емкость катионита Биокарб А, в качестве носителя для создания обратимо-диссоциирующего комплекса с протеазой, который проходил бы в связанной форме кислую среду желудка, его применять нецелесообразно. Таким образом, для создания кислотостойкой формы фермента в ходе дальнейшей работы использовали карбоксильный катионит типа Биокарб А различной степени дисперсности.
Изучение зависимости емкости сорбции от дисперсности катионита проводили в статических условиях при комнатной температуре на катионите с размером гранул 5 мкм, 15 мкм, 32 мкм, 53 мкм. Процесс сорбции осуществлялся в течение 24 часов. Для проведения эксперимента навески сухого сорбента, уравновешивали ацетатным буферным раствором с рН=6. Навески помещали в емкости малого объема, заливали 5 мл исследуемого раствора протосубтилина с одинаковой концентрацией. В исходном растворе проверяли протеолитическую активность. Сорбцию вели в течение 24 часов. По истечении времени сорбции во всех пробах измеряли ферментативную активность и рассчитывали обменную емкость. Полученные результаты представлены на рисунке 2.
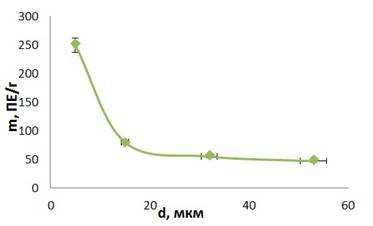
Рисунок 2. Зависимость емкости сорбции протеазы от дисперсности катионита Биокарб А
Из рисунка следует, что количество связанной протеазы резко падает при увеличении размера зерен сорбента с 5 до 15 мкм, а при размере гранул больше 15 мкм емкость сорбции практически не меняется. Кинетика ионного обмена существенным образом зависит от размера зерен ионитов. Это связано с тем, что при сильном измельчении зерен сорбента характерна пленочная кинетика (при этом очень высокий коэффициент диффузии), а при большем размере зерен сорбента – внутридуффузионная кинетика, которая связана с прохождением макромолекул по каналам внутрь сорбента. Поэтому наиболее медленной, лимитирующей стадией процесса при внутридиффузионной кинетике является прохождение макромолекулы внутрь сорбента.
Как видно из рис. 2, большую обменную емкость имеют сорбенты с размером зерен менее 15 мкм. Но за счет того, что они представляют собой очень мелкие пылевидные частицы, с ними неудобно работать. Кроме того, для получения таких зерен требуются дополнительные затраты на измельчение, его тяжело отделять от раствора, т.к. мелкие частицы забивают поры фильтра и процесс фильтрации идет медленно. Поэтому для создания кислотостойкой формы фермента были выбраны наиболее удобные размеры зерен сорбента с диаметром более 15 мкм, при котором их обменная емкость практически не меняется.
Полученную фармацевтическую композицию сравнивали с кислотостойкостью зарубежного препарата «Мезим форте».

Рисунок 3. Внешний вид таблетки препарата «Мезим форте» после кислотной инактивации в течение 15 мин (1) и 30 мин (2)
На данных рисунках видно, как меняется внешний вид таблетки препарата «Мезим форте» в среде желудочного сока (рН=2) по истечении 15 и 30 мин. За счет частичного разрушения кислотостойкой оболочки кислота проникает в ядро таблетки, фермент теряет какую-либо защиту от кислоты и идет процесс инактивации фермента.
Лекарственная форма протеазы должна быть устойчива в среде желудочного сока и проявлять свою активность в кишечнике при рН=7,6. На рисунке 4 представлена зависимость сохраненной активности фермента от времени выдержки в среде желудочного сока (рН=2).

Рисунок 4. Зависимость сохраненной активности фермента от времени выдержки в среде желудочного сока (рН=2)
Как видно, при рН=2 фермент инактивируется практически полностью за 10 мин, а полученный обратимо-диссоциирующий комплекс протеазы сохраняет свою активность за 20 мин на 70%, в то время как зарубежный препарат «Мезим форте» за то же время – на 40%. Повышенную устойчивость к кислотному воздействию полученному обратимо-диссоциирующему комплексу придает полимерная матрица катионита Биокарб А. Фермент, заключенный в гель ионита, подвергается атаке ионами водорода с гораздо меньшей скоростью, чем фермент в растворе.
Экспериментальные данные показали, что полученная нами фармацевтическая композиция может использоваться для создания новой лекарственной формы без кислотостойкой оболочки для лечения заболеваний желудочно-кишечного тракта.





