УСОВЕРШЕНСТВОВАННЫЙ ПОДХОД ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА
Конференция: LVII Международная научно-практическая конференция «Научный форум: инновационная наука»
Секция: Медицина и фармацевтика

LVII Международная научно-практическая конференция «Научный форум: инновационная наука»
УСОВЕРШЕНСТВОВАННЫЙ ПОДХОД ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА
AN IMPROVED APPROACH TO THE TREATMENT OF TUBERCULOSIS
Irina Krasnoselskikh
Senior Assistant, Ivanovo Medical Academy of the Ministry of Health of Russia, Russia, Ivanovo
Аннотация. Туберкулез органов дыхания в России был большой проблемой: с конца 1990-х до начала 2000-х наблюдался рост инфекции, люди легко заражались. Поэтому в настоящее время, когда на первый план вышла новая корановирусная инфекция, нельзя игнорировать такую опасную инфекцию, как туберкулез, которая являлась одной из актуальных проблем здравоохранения в мире. В условиях пандемии ковида нельзя забывать о туберкулезе, летальность у туберкулеза выше, чем у коронавирусной инфекции. Ежегодно в мире туберкулезом заболевают десять миллионов человек, полтора миллиона умирают.
Abstract. Respiratory tuberculosis in Russia was a big problem: from the late 1990s to the early 2000s, there was an increase in infection, people were easily infected. Therefore, at the present time, when a new coronavirus infection has come to the fore, one cannot ignore such a dangerous infection as tuberculosis, which was one of the urgent health problems in the world. In the context of the covid pandemic, one should not forget about tuberculosis, the lethality of tuberculosis is higher than that of coronavirus infection. Every year, ten million people fall ill with tuberculosis in the world, and one and a half million die.
Ключевые слова: туберкулез; впервые выявленные; спектр лекарственной устойчивости; мокрота; лекарственная форма.
Keywords: tuberculosis; first discovered; spectrum of drug resistance; sputum; dosage form.
В ВОЗ предупреждают, что после пандемии COVID-19 мир ждет новая вспышка туберкулеза, роста заболеваемости туберкулезом фтизиатры во всем мире опасаются в ближайшие год-два [1]. Каждый третий случай нового заражения – туберкулез с множественной лекарственной устойчивостью (МЛУ). Ожидается, что и в этом плане ситуация будет только ухудшаться, в том числе из-за злоупотребления антибиотиками во время пандемии и показателей смертности, в группах риска. Ожидается увеличение числа больных с тяжелыми остропрогрессирующими формами туберкулеза легких при широком распространении лекарственной устойчивости (ЛУ) микобактерий туберкулеза (МБТ) к основным и резервным противотуберкулезным препаратам [1],[2].
Применение разработанной нами усовершенствованной лекарственной формы, позволит осуществлять качественный контроль за приёмом больными лекарств, даже в период амбулаторного или домашнего лечения, будет способствовать завершению длительного курса противотуберкулезной терапии (ПТТ), снизит токсическое действие антибиотиков на организм и кроме этого, за счет применения нашей лекарственной формы, возможно, будет ингибировать рост и размножение МБТ, оказывать терапевтическую помощь пациентам, инфицированным штаммами Mycobacterium tuberculosis для предотвращения развития у них МЛУ на ранних этапах.
Цель: изучить лекарственную устойчивость МБТ и разработать новую лекарственную форму.
Материалы и методы. Исследование, проводили у впервые выявленных больных туберкулезом в терапевтическом и хирургическом отделениях ОБУЗ «Областной противотуберкулезный диспансер имени М.Б. Стоюннина», Наблюдение проводилось нами в течение трех лет с 2014-2016 г.г. Обследовали 146 пациентов c впервые выявленным туберкулезом легких по следующим категориям: гендерный признак, социальный статус, наличие вредных привычек, характер и распространенность туберкулезного процесса в легких, рентгенологическое обследование грудной клетки, результаты обследования на МБТ и их чувствительность, применённое комплексное лечение, включая хирургическое (режимы ХТ, патогенетическое лечение). Обследованные были разделены на две группы: основную – 70 больных, с впервые выявленным туберкулезом легких со скудным выделением мокроты и единичным ростом культуры МБТ и контрольную – 76 человек с аналогичной патологией и массивным ростом микробных колоний более 20 м/е [3]. Среди пациентов большую часть составили мужчины − 106 человек (73,1%) в возрасте 45,4±1,5 лет. Женщины − 40 человек (26,9%) в возрасте 43,2±1,7 лет.
Среди обследованных, мужчины – 52 чел. (74,29% основная группа) и 54 чел. (71,05% контрольная) [3]. Значимым в социально-экономическом отношении является то, что это лица находятся в трудоспособном возрасте (82,86%) основная группа и (92,10%) контрольная [3], причем 55,72% основной группы и 73,68% контрольной [3] приходилось на наиболее трудоспособную часть населения – 18-50 лет.
В 1 группе безработные составляли 26 чел. (37,14%), пенсионеры 13 чел. (18,57%), инвалиды 12 чел. (17,14%). В контрольной группе безработные составляли –16 чел. (21,05%), пенсионеры –21 чел. (27,63%), инвалиды –14 чел. (18,42%) [3]. Работающими в основной и контрольной группах были более 50% обследованных лиц. До установления диагноза туберкулез курили большинство, обследованных (98,20%). Однако с начала противотуберкулезной терапии многие пациенты отказались от курения (98,40%). Злоупотребляли алкоголем 43,84% больных и также в процессе химиотерапии большая часть отказалась от злоупотребления алкоголем.
Проводили бактериологическое исследование 889 образцов мокроты, с последующим определением ЛУ методом абсолютных концентраций.
Исследуемый материал (мокрота) приготавливали по общепринятой методике, руководствуясь приказом №109 [11].
У каждого больного проводили статистический анализ не менее 12-15 антибиотикограмм т. е. 1050 антибиотикограмм в соответствии с общепринятой методикой. Всем больным при поступлении, а так же через 2-3 месяца от начала химиотерапии, в начале 5 месяца химиотерапии и по окончании курса химиотерапии исследовали мокроту методом прямой микроскопии мазка, окрашенного по Ziehl-Neelsen.
Определяли частоту кислотоустойчивых микобактерий (КУМ) методом прямой бактериоскопии мокроты от больных исследуемых групп.
Количество больных, у которых КУМ были выявлены методом прямой бактериоскопии: в основной группе при ЛУ бактериовыделением – 79,07% и с ЛЧ бактериовыделением – 29,63%. В контрольной группе при ЛУ бактериовыделении – 57,14% и при ЛЧ бактериовыделении – 60,00%,[3].
Определяли спектр лекарственной устойчивости штаммов МБТ у больных основной и контрольной групп к основным противотуберкулезным препаратам. Спектр лекарственной устойчивости у больных, исследуемых групп: к стрептомицину S – 36 (51,43%) – основная группа, 55 (72,37%) – контрольная [3]; к рифампицину R – 33 (47,14%) – основная группа, 42 (55,26%) – контрольная [3].
Почти одинаково устойчивость распределилась между изониазидом Н – 27 (38,57%) – основная группа, 21 (27,63%) – контрольная [3]; и этамбутолом Е – 23 (32,86%) – основная группа, 24 (31,58%) – контрольная [3].
Определяли устойчивость к препаратам 2 ряда: этионамиду Еа у – 11 (15,71%) – основная группа, 15 (19,74%) – контрольная, [3] и к канамицину К – 9, основная группа 11(12,86%), 11(14,47%) – контрольная [3].
В ходе исследования появилась необходимость в определении сроков, в течение которых возможно определение спектра ЛУ для раннего начала этиологического лечения.
Так спектр лекарственной устойчивости распределился следующим образом: к одному-трем противотуберкулезным препаратам (ПТП), например: к S и R; или к S, Еа, R кроме МЛУ (в течение одного-трех месяцев от начала специфического лечения) у 4 (8,57%) пациентов из основной группы. МЛУ примерно (через 3-4 месяца) у 16 (37,14%) больных основной группы, к шести препаратам примерно (через 7-9 месяцев) у 23 (54,29%) больных.
У больных контрольной группы к одному-трем препаратам (в течение одного-трех месяцев от начала специфического лечения) устойчивые к двум и более противотуберкулезным препаратам (ПТП), например: к S и R; или к S, Еа, R кроме МЛУ – у 36 (47,37%) больных. МЛУ у больных контрольной группы составила 13 (17,11%) и так же через 3-4 месяца. К шести препаратам так же примерно (через 7-9 месяцев) у 27 (35,53% пациентов [3].
Изучали распределение больных в зависимости от характера лекарственной устойчивости МБТ в основной группе и контрольной: монорезистентность, полирезистентность, множественная лекарственная устойчивость.
У пациентов основной группы, имеется высокий уровень полирезистентности к двум и более ПТП, кроме сочетания изониазида и рифампицина 23 (54,29%) больных и 36 (47,37%) контрольная группа) [3], её МЛУ 16 (37,14% и 13 (17,11%), основная и контрольная группы.
При культуральном исследовании скудный рост микробных колоний МБТ у больных основной группы с различным спектром лекарственной устойчивости выявлялся, когда в спектр моно или МЛУ входил R (48,84% и 13,95%).
Скорость роста до 1 мес. у больных с ЛУ бактериовыделением была: 18,60% – основная группа и 23,21% – контрольная; с ЛЧ бактериовыделением, 3,70% основная группа и 5,00% контрольная,[3].
В наблюдаемых группах преобладали пациенты, у которых рост культуры выявлялся в период 1-2 мес. одинаково часто у больных с ЛУ и ЛЧ бактериовыделением 69,77 и 70,37% – основная группа и 60,71 и 80,00% – контрольная [3].
Длительный рост культуры МБТ, 2-3 мес. был у больных с ЛУ бактериовыделением: 11,63% – основная группа, и 18,08% – контрольная [3]. Кроме этого длительный рост культуры – 2-3 мес. выявлялся чаще у больных, в спектр монорезистентности которых входил Н (33,33%), чем у больных с МЛУ (4,76%) возбудителя, основная группа и чем если в спектре моно- и МЛУ присутствовал R (12,50 и 4,76%) так же в основной группе.
Проводили изучение фазы и объема туберкулезного процесса в исследуемых группах. У больных, выделяющих МБТ чувствительные к (противотуберкулезным препаратам) ПТП, двухсторонние процессы встречались в 29,63% случаев, тогда как у больных, выделяющих устойчивый возбудитель, этот показатель составлял 30,23%. Двухстороннее поражение наблюдалось чаще у больных, в спектр моно- и множественной лекарственной устойчивости которых входил Н (50,00% и 33,33%), основная группа.
У больных, в спектре монорезистентности которых присутствовал рифампицин и изониазид, клинические проявления одинаково часто характеризовались распадом (50,00% и 50,00%), чем при МЛУ (14,29%). Обсеменение также чаще выявлялось у больных с ЛУ бактериовыделением по сравнению с больными, выделяющими возбудитель чувствительный к противотуберкулезным препаратам (ПТП) (37,21% и 14,81%), основная группа.
Чаще наблюдалось обсеменение, когда в спектре монорезистентности присутствовал изониазид (33,33%), чем, когда в спектре монорезистентности присутствовал рифампицин (31,25%) и чем МЛУ (28,57%), основная группа. Обострения встречались чаще у пациентов, в спектр монорезистентности которых входил R (23,26%), чем у больных, в спектр моно-и МЛУ входил H (11,63 и 18,60%), так же в основной группе.
При изучении фазы туберкулезного процесса у больных основной группы распад легочной ткани чаще выявлялся в группе ЛУ бактериовыделения, чем в группе ЛЧ бактериовыделения (62,79% и 44,44%).
Показатели частоты негативации мазка мокроты у больных основной группы в различные сроки от начала лечения при ЛЧ бактериовыделении (через 2-3 мес.) составили 96,30%; у больных с ЛУ бактериовыделением – 69,77%.
Продолжительный прием одновременно большого количества противотуберкулезных препаратов, с целью избежания монотерапии и предупреждения развития лекарственной резистентности микобактерий, применение адекватных режимов химиотерапии туберкулеза не всегда благоприятно сказывается на общем состоянии пациентов, так как часто возникают неустранимые побочные реакции, что сильно затрудняет дальнейшее лечение и приводит пациентов к отказу от необходимой терапии. Известно, что лечение достаточной длительности под контролем медицинского персонала, приводит к излечению большинства больных туберкулезом [3, 5].
Поэтому нами разработана усовершенствованная лекарственная форма, капсула для снижения сопутствующих побочных явлений от антибиотиков и предупреждения развития лекарственной устойчивости микобактерий [8, 9].
Результаты и обсуждение. Установлено, что в сроки до 1 года и более 1 года лечения у больных с ЛЧ бактериовыделениием КУМ в мазке мокроты отсутствовали. При ЛУ бактериовыделении негативация мазка мокроты в сроки (до 1 года) происходила у 2,33% больных; в сроки (больше 1 года) у 6,98% пациентов.
Показатели прекращения бактериовыделения по результатам культуральных исследований оказались достоверно ниже у больных с ЛУ бактериовыделением (через 2-3 мес.) – 53,49%, чем у больных с ЛЧ бактериовыделением – 92,59%. В сроки до 1 года и более 1 года лечения прекращение бактериовыделения по результатам культуральных исследований наступало всего лишь у 4,65% больных.
Изучали данные о структуре клинических форм у исследуемых групп больных туберкулезом легких в зависимости от характера лекарственной устойчивости возбудителя.
У больных основной группы при единичном росте культуры МЛУ МБТ в 24,29% случаев была представлена инфильтративной формой; у больных с моноустойчивостью эта форма туберкулеза составила 5,71%, с ПЛУ – 14,29%. Что же касается диссеминированного туберкулеза, то отмечено, что ПЛУ составила 5,71%, а множественная лекарственная устойчивость – 2,86%. Очаговый туберкулез встречался у больных основной группы только при ПЛУ, что составило – 1,43%.
У больных из контрольной группы МЛУ составила 15,79% случаев и также была представлена инфильтративной формой, с моноустойчивостью – 19,74%, с ПЛУ – 31,58%. При диссеминированном туберкулезе ПЛУ составила 5,26%, а МЛУ 1,32%. Очаговый туберкулез у больных контрольной группы встречался при моноустойчивости, что составило – 1,32%, и ПЛУ – 2,63%.
В комплексном лечении больных туберкулезом, ежедневно в течение длительного времени (6-12 месяцев и более) применяют не менее 4-х противотуберкулезных препаратов. Для лучшего сотрудничества между врачом и пациентом существуют стратегии повышения приверженности. На современном этапе стратегическим направлением повышения приверженности является создание препаратов, способных снизить нагрузку при однократном приеме наименьшего числа лекарственных форм, обладающих минимальным побочным действием (Рисунок 1). Основываясь на рекомендации V конференции Международного Союза по борьбе с туберкулезом и болезнями легких, использование комбинаций препаратов с фиксированной дозой должно рассматриваться как мера по предотвращению лекарственной устойчивости.
С 2000 года ОАО «АКРИХИН» совместно с НИИ фтизиопульмонологии ММА им. И.М. Сеченова приступил к созданию комбинированных препаратов:
Изокомб®, Протиокомб® Ломекомб®
Рисунок1. Контролируемая химиотерапия больных туберкулезом легких
В настоящее время в связи с увеличением частоты развития лекарственно-устойчивого туберкулеза, агрессивным течением заболевания и неэффективными результатами стандартной химиотерапии, возникла необходимость в поиске новых методов и организационных форм лечения больных. Для преодоления ЛУ МБТ одним из мероприятий является рациональная антимикробная терапия, включающая комплаентность пациента и разработку новых антибактериальных препаратов или новых лекарственных форм известных антимикробных препаратов. Ключевым фактором успешной антибиотикотерапии является комплаентность – степень приверженности больных назначенному лечению. Кроме того, необходимо, чтобы на протяжении всего лечения комплаентность у пациента составляла >85%.
Одной из причин развития множественной лекарственной устойчивости являлся отказ пациентов от лечения или нарушение режимов приема препаратов из-за сопутствующих нежелательных токсических реакций (например, изониазида и др. противотуберкудезных препаратов).
Для снижения токсичности препарата – изониазида у больных с туберкулезом легких первоначально нами предложена капсула для лекарственных и\или витаминных препаратов, выполненная, по крайней мере, из двух оболочек с возможностью размещения разных (порошкообразных и жидких) препаратов между стенками. Как представлено на рисунке 2, капсула для лекарственных и/или витаминных препаратов, содержит крахмальную (желатиновую) оболочку (1), с заключенной в нее аналогичной оболочкой (2). Оболочки имеют, соответственно, растворимые в организме человека стенки (3) и (4). В оболочку (2) со стенкой (4), помещают жидкий витаминный препарат пиридоксин, снижающий негативные реакции изониазида. В оболочку (1) со стенкой (3), имеющей тот же период растворения, помещают твердый противотуберкулезный препарат изониазид, угнетающий синтез миколевой кислоты в клеточной оболочке микобактерий, а также оказывающий бактерицидное действие на медленно растущие микобактерии.

Рисунок 2. Капсула для лекарственных и/или витаминных препаратов [8]
Для снижения токсичности изониазида и др. противотуберкулезных препаратов нами предложена усовершенствованная лекарственная форма – капсула, включающая одновременно изониазид, пиридоксин, этамбутол и рифампицин. Капсула включает три основных противотуберкулезных препарата I и II групп с различным механизмом антибактериального действия и витаминного препарата. Препараты разделены четырьмя оболочками, с растворимыми в организме человека стенками, имеющими разную временную устойчивость к растворению в ЖКТ.
Растворение 1-ой оболочки, состоящей из желатина, происходит 15-20 мин и ведет к поступлению в ЖКТ противотуберкулезного препарата изониазида. Растворение 2-ой оболочки, состоящей из желатина, обработанного парами формальдегида (для устойчивости к воздействию желудочного сока) происходит через 20-30 минут и ведет к поступлению в организм витаминного препарата пиридоксина. При растворении 3-ей оболочки из ацетилфталилцеллюлозы, которое происходит в кишечнике за 30 минут, ведет к высвобождению противотуберкулезного препарата этамбутола. Антимикробное действие развивается через 1-2 дня. Максимальная концентрация в плазме крови создается через 2-4 дня. Период полувыведения составляет 3-4 часа. Растворение 4-й оболочки из этилцеллюлозы с микропористой структурой происходит − через 1,5-2 часа и ведет к поступлению в ЖКТ противотуберкулезного препарата I группы (высокой эффективности) рифампицина. Пик концентрации в плазме крови отмечается через 2 ч. Период полувыведения составляет 1-4 ч. [9], [7].
Уникальность разработки в том, что антибактериальные препараты, действующие на разные мишени в м./к., не смешиваются друг с другом. Не наблюдается взаимодействия активных компонентов капсулы на фармакокинетическом и микробиологическом уровнях т.к. оболочки капсулы имеют разную временную устойчивость к растворению в ЖКТ. Таким образом, достигается отсроченный по времени лечебный эффект.
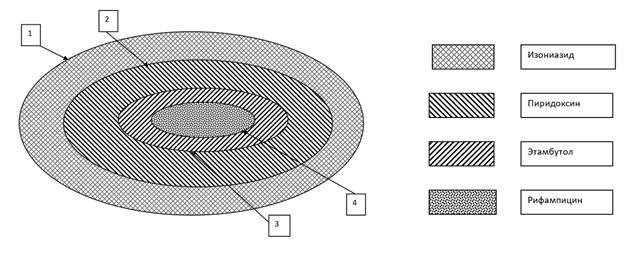
Рисунок 3. Капсула для лекарственных и/или витаминных препаратов [9]
Выводы. Количество больных, у которых КУМ были выявлены методом прямой бактериоскопии, достоверно больше в основной группе при ЛУ бактериовыделении, что составило – 79,07% и с ЛЧ бактериовыделением 29,63%, (79,07% и 29,63%, р<0,001). В контрольной группе при ЛУ бактериовыделении 57,14% и при ЛЧ бактериовыделении – 60,00% [3]. В контрольной группе достоверных отличий не выявлено.
При проведении мониторинга лекарственной устойчивости МБТ у больных было выявлено, что наиболее часто встречались штаммы, устойчивые к основным (ПТП): так к основному препарату стрептомицину: у 51,43% – основная группа, 72,37% – контрольная; [3] к рифампицину R – 47,14% – основная группа, 55,26% – контрольная [3]. Почти одинаково устойчивость распределилась между изониазидом Н – 38,57% – основная группа, 27,63% – контрольная [3]; и этамбутолом Е – 32,86% – основная группа, 31,58% – контрольная [3]. Сравнительно реже определялась устойчивость к препаратам 2 ряда: этионамиду Еа у 15,71% – основная группа, 19,74% – контрольная [3], к канамицину К – 12,86% – основная группа, 14,47% – контрольная [3].
В ходе проведенного мониторинга наблюдали постепенное нарастание резистентности к ПТП за разный временной период у больных основной группы и контрольной. Так устойчивость к изониазиду с 25,7% за период 1-3 мес. увеличилась, и стала к концу 3-4 мес. – у 28,6%; с 7-9 мес. − у 37,14%. Похожие изменения наблюдали и в отношении рифампицина, а именно – с 47,1% за четыре месяца до показателя 51,4% за период 7-9 мес.; у этамбутола с 27,1% за четыре месяца и до 31,4% за период 7-9 мес специфического лечения у пациентов основной группы.
У больных контрольной группы к одному-трем препаратам (в течение одного-трех месяцев от начала специфического лечения) устойчивые к двум и более противотуберкулезным препаратам (ПТП), например: к S и R; или к S, Еа, R кроме МЛУ – у 47,37% больных. МЛУ у больных контрольной группы составила 17,11% и так же примерно через 3-4 месяца. К шести препаратам (через 7-9 месяцев) у 35,53% пациентов [3].
Кроме того у пациентов основной группы, имеется высокий уровень полирезистентности к двум и более (ПТП), кроме МЛУ основная группа 54,29% больных и 47,37% – контрольная группа [3], её МЛУ основной и контрольной групп 37,14% и 17,14%, соответственно (р<0,01).
При культуральном исследовании скудный рост микробных колоний МБТ у больных основной группы с различным спектром лекарственной устойчивости выявлялся, когда в спектр моно или МЛУ входил R (48,84% и 13,95%, р<0,001); (37,21% и 13,95%, р<0,02).
У больных основной группы при единичном росте культуры МЛУ МБТ в 24,29% случаев была представлена инфильтративной формой; у больных с моноустойчивостью эта форма туберкулеза составила 5,71%, с полиустойчивостью – 14,29%. Что же касается диссеминированного туберкулеза, то отмечено, что полиустойчивость составила 5,71%, а МЛУ – 2,86%. Очаговый туберкулез встречался у больных основной группы только при полиустойчивости, что составило – 1,43%.
У больных из контрольной группы МЛУ составила 15,79% случаев и также была представлена инфильтративной формой, с моноустойчивостью – 19,74%, с полиустойчивостью – 31,58%. При диссеминированном туберкулезе полиустойчивость составила 5,26%, а МЛУ 1,32%. Очаговый туберкулез у больных контрольной группы встречался при моноустойчивости, что составило – 1,32%, и полиустойчивости – 2,63%.
Страдали инфильтративной формой туберкулеза легких – 44,29% больных из основной группы, при этом у 14,29% определялась культура МБТ с ПЛУ, у 24,29% штаммы МБТ проявляли МЛУ. Больные контрольной группы страдали инфильтративной формой туберкулеза легких – 67,11% пациентов, при этом МЛУ составила 15,79% случаев и также была представлена инфильтративной формой с моноустойчивостью – 19,74%, с полиустойчивостью – 31,58%.
Скорость роста до 1 мес. у больных с ЛУ бактериовыделением была: 18,60% – основная группа и 23,21% – контрольная; с ЛЧ бактериовыделением, основная группа 3,70% и 5,00% – контрольная.
В наблюдаемых группах преобладали пациенты, у которых рост культуры выявляется в период 1-2 мес. одинаково часто у больных с ЛУ и ЛЧ бактериовыделением: 69,77 и 70,37% – основная группа и 60,71 и 80,00% –контрольная [3].
Длительный рост культуры МБТ, 2-3 мес. был у больных с ЛУ бактериовыделением – 11,63% основная группа, и 18, 08% – контрольная [3]. Кроме этого длительный рост культуры 2-3 мес. выявлялся чаще у больных, в спектр монорезистентности которых входил Н (33,33%), чем у больных с МЛУ (4,76%) возбудителя, основная группа и чем если в спектре моно- и МЛУ присутствовал R (12,50 и 4,76%) так же в основной группе.
Обсеменение чаще выявлялось у больных с ЛУ бактериовыделением по сравнению с больными, выделяющими возбудитель чувствительный к ПТП (37,21% и 14,81%, р<0,01), что может служить подтверждением достаточно высокой вирулентности культуры МБТ у больных основной группы. У больных, выделяющих МБТ чувствительные к ПТП, двухсторонние процессы встречались в 29,63% случаев, тогда как у больных, выделяющих устойчивый возбудитель, этот показатель составлял 30,23%. Двухстороннее поражение наблюдалось чаще у больных, в спектр моно- и МЛУ которых входил Н (50,00% и 33,33%).
У больных, в спектре монорезистентности которых присутствовал рифампицин и изониазид, клинические проявления одинаково часто характеризовались распадом (50,00% и 50,00%), чем при МЛУ (14,29%). Чаще наблюдалось обсеменение, когда в спектре монорезистентности присутствовал изониазид (33,33%), чем, когда в спектре монорезистентности присутствовал рифампицин (31,25%) и чем при МЛУ (28,57%). Обострения встречались чаще у пациентов, в спектр монорезистентности которых входил R (23,26%), чем у больных, в спектр моно-и МЛУ входил H (11,63 и 18,60%, p<0,05).
При изучении фазы туберкулезного процесса у больных основной группы распад легочной ткани чаще выявлялся в группе ЛУ бактериовыделения, чем в группе ЛЧ бактериовыделения (62,79% и 44,44%, p<0,001). Обсеменение также чаще выявлялось у больных с ЛУ бактериовыделением по сравнению с больными, выделяющими возбудитель чувствительный к ПТП (37,21% и 14,81%, р<0,01), что так же может служить подтверждением достаточно высокой вирулентности культуры МБТ у больных основной группы. У больных, выделяющих МБТ чувствительные к ПТП, двухсторонние процессы встречались в 29,63% случаев, тогда как у больных, выделяющих устойчивый возбудитель, этот показатель составлял 30,23%. Двухстороннее поражение наблюдалось чаще у больных, в спектр моно- и МЛУ которых входил Н (50,00% и 33,33%).
Показатели частоты негативации мазка мокроты у больных основной группы в различные сроки от начала лечения при ЛЧ бактериовыделении (через 2-3 мес.) составили 96,30%; у больных с ЛУ бактериовыделением – 69,77% (р<0,01), что свидетельствует о меньшей эффективности лечения по частоте и срокам негативации мазка мокроты .
В сроки до 1 года и более 1 года лечения у больных с ЛЧ бактериовыделениием КУМ в мазке мокроты отсутствовали. При ЛУ бактериовыделении негативация мазка мокроты в сроки (до 1 года) происходила у 2,33% больных; в сроки (больше 1 года) у 6,98% пациентов, что также свидетельствует о меньшей эффективности лечения по частоте и срокам негативации мазка мокроты больных основной группы с ЛУ бактериовыделением.
Показатели прекращения бактериовыделения по результатам культуральных исследований оказались достоверно ниже у больных с ЛУ бактериовыделением (через 2-3 мес.) – 53,49%, чем у больных с ЛЧ бактериовыделением – 92,59%. В сроки до 1 года и более 1 года лечения прекращение бактериовыделения по результатам культуральных исследований наступало всего лишь у 4,65% больных, что также свидетельствует о меньшей эффективности лечения по результатам культурального исследования основной группы больных с ЛУ бактериовыделением.
В основной группе большинство больных выделяли МБТ, устойчивые к двум и более противотуберкулезным препаратам (ПТП) – 54,29%. МЛУ у больных основной группы составила 37,14%, монорезистентность у 8,57%.
В контрольной группе больных выделяли МБТ, устойчивые к двум и более ПТП – 47,37% пациентов. МЛУ составила 17,11%, монорезистентность у 35,53%.
МЛУ у больных основной группы составила 37,14%, тогда как контрольной 17,11% (р<0,01).
У больных скудный рост культуры чаще наблюдался, когда в спектр множественной лекарственной устойчивости входил R (48,84% и 13,95%, р<0,001; 37,21% и 13,95%, р<0,02).
Быстрый рост культуры МБТ (до 1 мес.), чаще встречался, когда в спектре лекарственной устойчивости присутствовал R (18,75 и 19,05%).
Длительный рост культуры 2-3 мес. выявлялся чаще у больных, в спектр монорезистентности которых входил Н (33,33%), чем у больных с МЛУ (4,76%) возбудителя, и чем если в спектре моно- и МЛУ присутствовал R (12,50 и 4,76%).
Распад легочной ткани чаще выявлялся в группе ЛУ бактериовыделения, чем в группе ЛЧ бактериовыделения (62,79% и 44,44% соответственно).
Обсеменение чаще выявлялось у больных с ЛУ бактериовыделением по сравнению с больными, выделяющими возбудитель чувствительный к ПТП (37,21% и 14,81%, p<0,05), что может служить подтверждением высокой вирулентности культуры МБТ у больных основной группы.
Двухсторонние процессы у больных с ЛУ бактериовыделением составил 30,23%, с ЛЧ бактериовыделением двухсторонние процессы встречались в 29,63% случаев.
Анализ характера поражения легочной ткани у больных основной группы с различным спектром ЛУ показал, что распад легочной ткани встречался одинаково у больных, в спектр монорезистентности которых входил R (50,00%) и Н (50,00%). Двухстороннее поражение встречалось чаще у больных, в спектр монорезистентности которых входил Н (50,00%) и множественой лекарственной устойчивости (33,33%).
Обострения встречались чаще у пациентов, в спектр монорезистентности которых входил R (23,26%), чем у больных, в спектр моно- и полирезистентности которых входил H (11,63 и 18,60%, p<0,05).
Двухстороннее поражение встречалось чаще у больных, в спектр моно- и множественной лекарственной устойчивости которых входил Н (50,00 и 33,33%).
Так, через 2-3 мес. лечения, негативация мазка мокроты наступала у 96,30% больных с ЛЧ бактериовыделением, с ЛУ бактериовыделением негативация мазка мокроты наступала у 79,07% больных, и у 69,77% пациентов с ЛУ бактериовыделением. В сроки до 1 года и более 1 года лечения у больных с ЛЧ бактериовыделениием КУМ в мазке мокроты не определяли, тогда, как при ЛУ бактериовыделении негативация мазка мокроты происходила (до 1 года) только у 2,33% пациентов; больше 1 года у 6,98% больных, 92,59% – с ЛЧ бактериовыделением и 53,49% человек – с ЛУ (p<0,001), что свидетельствует о меньшей эффективности лечения по частоте и срокам негативации мазка мокроты больных основной группы с ЛУ бактериовыделением.
Результаты культурального исследования у больных основной группы показатели прекращения бактериовыделения в различные сроки показал, что через 2-3 мес. лечения у пациентов с ЛУ бактериовыделением только у 26 пациентов, при ЛЧ бактериовыделении происходило прекращение бактериовыделения у 96,30% больных, наступало прекращение бактериовыделения.
Анализ показателя прекращения бактериовыделения по результатам посева выявил, что через 2-3 мес. лечения бактериовыделение прекращалось у 92,59% больных с ЛЧ бактериовыделением, тогда как с ЛУ бактериовыделением всего лишь у 79,07% пациентов. В сроки до 1 года лечения и более 1 года, прекращение бактериовыделения по результатам культурального исследования наступало всего лишь у 4,65% больных.
Эффективность лечения, которая рассматривалась в виде частоты и сроков негативации мокроты по мазку и по результатам культурального исследования, оказалась значительно ниже у больных основной группы, выделяющих ЛУ МБТ, чем в группе больных с ЛЧ бактериовыделением.
Научно обоснована целесообразность использования лекарственной формы, которая позволит, снизить токсическое действие антибиотиков на организм. Применение её позволит осуществлять качественный контроль за приёмом больными лекарств, использование лекарственной формы будет способствовать завершению длительного курса противотуберкулезной терапии, улучшению качества жизни, психоэмоционального статуса пациентов и роста их заинтересованности в процессе лечения. За счет применения разработанной нами лекарственной формы, возможно, будет ингибировать рост и размножение МБТ, оказывать терапевтическую помощь пациентам, инфицированным штаммами Mycobacterium tuberculosis для предотвращения развития у них МЛУ на ранних этапах.
Применение лекарственной разработки актуально для лечения больных туберкулезом, что является непременным условием для успешной терапии данных больных, кроме того, она будет способствовать достижению необходимого лечебного эффекта у больных.
Предлагаемая нами лекарственная разработка, капсула, уникальность которой заключается в том, что антибактериальные препараты, действующие на разные мишени в м./к., не смешиваются друг с другом. Не наблюдается взаимодействия активных компонентов капсулы на фармакокинетическом и микробиологическом уровнях т.к. оболочки капсулы имеют разную временную устойчивость к растворению в ЖКТ. Таким образом, достигается отсроченный по времени лечебный эффект.


