Дизайн новых потенциальных ингибиторов ионного канала M2 вируса гриппа на основе аллильных субстратов каркасной структуры
Конференция: XX Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Медицинская химия

XX Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Дизайн новых потенциальных ингибиторов ионного канала M2 вируса гриппа на основе аллильных субстратов каркасной структуры
Design of new potential inhibitors of the influenza M2 ion channel based on unsaturated cage compounds
Vadim Shiryaev
PhD, associate Professor, Samara State Technical University, Russia, Samara
Marat Baimuratov
PhD, senior researcher, Samara State Technical University, Russia, Samara
Maria Nekrasova
PhD, master's degree student, Samara State Technical University, Russia, Samara
Marina Leonova
PhD, associate Professor, Samara State Technical University, Russia, Samara
Yuri Klimochkin
Doctor of Chemical Sciences, Head of the Department of Organic Chemistry, Samara State Technical University, Russia, Samara
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект РФФИ 18-33-00994 мол_а).
Аннотация. Соединения полиэдрановой структуры, в том числе производные адамантана являются веществами широкого спектра противовирусной активности в отношении ряда вирусов из различных семейств (таксономических групп). Кроме того, перспективными для создания противовирусных препаратов, эффективных для терапии вирусных инфекций, являются препараты на основе гетероциклических соединений, содержащих каркасный фрагмент и соединения полиэдрановой структуры. Создана библиотека из 100 виртуальных соединений-кандидатов на основе субстратов каркасной структуры. Проведена оценка связывания потенциальных биологически активных соединений полиэдрановой структуры с ионными каналами M2WT, M2S31N и M2V27A вируса гриппа с помощью молекулярного докинга. На основе данных молекулярного докинга было выявлено 6 наиболее перспективных структур – винилдигидрофураны, дигидробензодиазоцин, дигидробензодиоксоцин и бензоксазоцин адамантанового ряда.
Abstract. The compounds of the polyhedral structure, including adamantane derivatives, are substances of a wide spectrum of antiviral activity against a number of viruses from different families (taxonomic groups). In addition, promising for the creation of antiviral drugs that are effective for the treatment of viral infections are drugs based on heterocyclic compounds containing a cage fragment and compounds of polyhedral structure. A library of 100 virtual candidate-compounds based on cage structure substrates was created. The binding of potential biologically active compounds of the polyhedral structure with ion channels M2WT, M2S31N and M2V27A of the influenza virus using molecular docking was evaluated. Based on molecular docking data, 6 of the most promising structures were identified - vinyl dihydrofurans, dihydrobenzodiazocine, dihydrobenzodioxocine, and benzoxazocine of the adamantane series.
Ключевые слова: каркасные соединения; антивирусная активность; молекулярный докинг; ионный канал M2; адамантан; аллильные субстраты.
Keywords: cage compounds; antiviral activity; molecular docking; M2 ion channel; adamantane; allyl substrates.
За последние десятилетия наблюдается значительное увеличение числа противовирусных препаратов, терапевтически ценных для лечения угрожающих жизни или приносящих значительный ущерб здоровью населения заболеваний вирусной этиологии. Эти сравнительно недавние достижения связаны с развитием молекулярной биологии, техническим прорывом в культивировании многих вирусов в лаборатории и идентификацией вирусных ферментов [1]. Однако склонность вирусов к мутациям с образованием новых форм, а также отсутствие до настоящего времени эффективных лекарственных средств для лечения и профилактики значительной части вирусных инфекций диктует необходимость постоянного поиска новых противовирусных соединений.
Повышенный интерес к каркасным соединениям как антивирусным агентам связан с особенностями пространственного строения производных этого класса, высокой липофильностью и жесткостью углеводородного каркаса, что позволяет легко проникать этим соединениям через липидный слой биологических мембран [2, 3]. Анализ циклических фрагментов, входящих в структуру одобренных к применению лекарственных препаратов, показал, что из 100 наиболее часто встречающихся кольцевых систем в молекулах лекарственных средств адамантан занимает 50-е место [4].
В последнее время существенно возросло количество научных публикаций и обзоров зарубежных и российских исследователей, посвященных медицинской химии каркасных соединений [3, 5-13], в том числе и антивирусным свойствам. Каркасные соединения оказались активными в отношении очень широкого спектра РНК- и ДНК-геномных вирусов [14]: гриппа, парагриппа, саркомы птиц, бешенства, герпеса, табачной мозаики, гепатита, аденовирусов, риновирусов, ортопоксвирусов, вируса болезни Ньюкасла, РС-вируса, вирусов везикулярного стоматита, ЕСНО-6, полиомиелита, Коксаки, вирусов ВИЧ-1 и ВИЧ-2 и др.
В настоящее время все чаще используется направленный поиск ингибиторов, действующих на заранее определенную биомишень. Для этих целей наиболее эффективным подходом является метод виртуального скрининга, в том числе молекулярный докинг, который позволяет провести оценку связывания виртуальной структуры с молекулой белка. Располагая структурной информацией, можно с помощью методов молекулярного докинга моделировать геометрию координации химических соединений в активных центрах белков и рассчитать специфичность их воздействия по отношению к известной белковой мишени.
Для успешного поиска новых соединений, обладающих заданными свойствами, и предсказания селективности низкомолекулярных ингибиторов был проведен досинтетический анализ библиотеки каркасных структур, различающихся расположением и комбинацией функциональных групп в боковой цепи, а также наличием или отсутствием ароматических, или гетероароматических фрагментов. Структуры были предложены на основании анализа литературных данных, в том числе по структурному сходству с известными активными соединениями. Для проведения оценки связывания потенциальных биологически активных веществ с ионными каналами M2-S31N и M2‑V27A, а также ионного канала «дикого» типа M2-WT были использованы ранее полученные модели [15].
Оценка связывания потенциальных биологически активных соединений полиэдрановой структуры с ионными каналами производилась при помощи молекулярного докинга в программе AutoDock Vina. Были определены значения свободных энергий связывания для всех структур и в результате найдены 6 лигандов, которые показали сильное взаимодействие с ионными каналами всех типов и 3 соединения, показавшие высокую ингибирующую активность только в отношении мутантного ионного канала M2V27A (Таблица 1, рисунок 1).
Таблица 1.
Структуры, показавшие наименьшие свободные энергии связывания с ионными каналами M2-WT, M2-S31N и M2-V27A в ходе молекулярного докинга 1-205 и 21-2368
|
Структура |
M2-WT |
M2-S31N |
M2-V27A |
|
Энергия связывания, ккал/мол |
|||
|
|
-10,26 |
-9,24 |
-9,92 |
|
|
-10,19 |
-9,49 |
-9,81 |
|
|
-10,29 |
-9,65 |
-9,85 |
|
|
-9,99 |
-8,84 |
-9,57 |
|
|
-10,05 |
-9,43 |
-9,82 |
|
|
-10,06 |
-9,27 |
-9,83 |
|
|
-6,92 |
-4,93 |
-10,44 |
|
|
-8,5 |
-8,25 |
-10,57 |
|
|
-7,48 |
-5,79 |
-11,36 |

Рисунок 1. Комплекс оксазепина 6 с ионным каналом вируса гриппа дикого типа
Заключение. Таким образом, заметная активность каркасных соединений в отношении вируса гриппа, показанная при помощи молекулярного докинга дает возможность считать, что важный вклад вносит полициклический каркас. Также, следует отметить, что перспективными ингибиторами вируса гриппа являются 8-ми и 10-ти членные гетероциклы содержащие 1 или 2 адамантановых фрагмента, а также различные винилдигидрофураны адамантанового ряда.

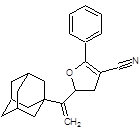 1
1 2
2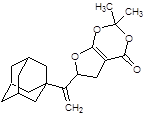 3
3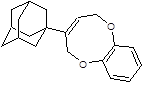 4
4 5
5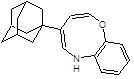 6
6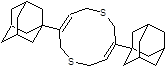 7
7 8
8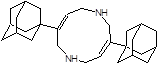 9
9