ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ 1,3,5-ЦИКЛОГЕПТАТРИЕНА В ОРГАНИЧЕСКОЙ СРЕДЕ
Журнал: Научный журнал «Студенческий форум» выпуск №2(181)
Рубрика: Химия

Научный журнал «Студенческий форум» выпуск №2(181)
ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ 1,3,5-ЦИКЛОГЕПТАТРИЕНА В ОРГАНИЧЕСКОЙ СРЕДЕ
ELECTROCHEMICAL OXIDATION 1,3,5-CYCLOHEPTATRIENE IN ORGANIC MEDIUM
Nikulin Alexander Alexandrovich
Master's student, Institute of Oil and Gas, Astrakhan State Technical University, Russia, Astrakhan
Аннотация. Препаративный электрохимический синтез является универсальным методом проведения экологически чистых технологических процессов. Данный подход позволяет избегать накопления отходов реагента и поддерживать мягкие условия реакции. В промышленном контексте электросинтез является альтернативной современной технологией, которая отличается высокой экономичностью, экологичностью и безопасностью. Электросинтез можно контролировать на каждой его стадии, и в любое время процесс можно остановить
Abstract. Preparative electrochemical synthesis is a universal method of conducting environmentally friendly technological processes. This approach avoids the accumulation of reagent waste and maintains mild reaction conditions. In the industrial context, electrosynthesis is an alternative modern technology that is highly economical, environmentally friendly and safe. Electrosynthesis can be controlled at every stage, and the process can be stopped at any time
Ключевые слова: циклогептатриен-1,3,5, сероводород, электрохимическая активация, электросинтез.
Keywords: cycloheptatriene-1,3,5, hydrogen sulfide, electrochemical activation, electrosynthesis.
Как известно, циклогептатриен-1,3,5 (ЦГТ) и его производные являются структурно «нежестких» и способны на внутримолекулярные перестройки, которые характеризуются разрывом или образованием связей типа алицикл─элементо(металло-)центр. При проведении электрохимической реакции циклогептатриен-1,3,5 генерирует радикалы (или ион-радикалы) различной стабильности, которые могут выступать в качестве атакующих частиц в различных химических превращениях.
1-Метоксифенилциклогептатриен,1-и3-диметиламинофенилциклогептатриен превращаются в ходе анодного окисления в радикальные катионы, основной реакцией которых является депротонирование. Электрохимическое окисление протекает по пути радикальной катионной димеризации [4, 5].
ЦГТ рассмотрен для исследования способности редокс-активных циклических углеводородов, содержащих кратные связи, вступать в реакции S-функционализации с участием H2S. ЦГТ окисляется при потенциале 1,66 В (CH3CN), что свидетельствует об его одновременной активации с H2S (1,60 В) в условиях электролиза.
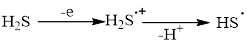
Процесс окисления ЦГТ малообратим и ведет к образованию циклогептатриенового катиона с конверсией 62,1 % (90 мин). Тиильный радикал генерируется из сероводорода посредством образования катион-радикала, фрагментирующегося с отщеплением протона.
Реакции ЦГТ с активированным H2S в условиях анодной активации H2S в потенциостатическом режиме проводили при различном мольном соотношении углеводород/сероводород. По окончанию реакции на ЦВА фиксировали 3 анодных пика, отвечающие образованию продуктов окислительного сочетания: циклогептантиол (R’SH, Епа2=1,76 В), дициклогептилдисульфид (R’2S2, Епа1=1,60 В) и дициклогептилсульфид (R’2S, Епа3=1,98 В) (табл. 1).
Таблица 1.
Зависимость выхода серосодержащих продуктов реакции циклогептатриена-1,3,5 с сероводородом и конверсии углеводорода от значения мольного соотношения компонентов (Еэл=1,9 В; СH3CN, Pt-анод, n-Bu4NClO4, Ag/AgCl, τ= 90 мин)
|
Мольное соотношение субстрат/реагент |
Выход продуктов реакции, % |
S, % |
Конверсия субстрата, % |
||
|
R’2S2 (1,60 В) |
R’SH (1,76 В) |
R’2S (1,98 В) |
|||
|
1:1,5 |
4,2 |
7,5 |
7,1 |
18,8 |
57,1 |
|
1:3,0 |
9,7 |
10,2 |
17,3 |
37,2 |
60,5 |
Как видно из табл. 1, увеличение концентрации H2S в реакционной смеси повышает суммарный выход продуктов реакции.
Изученные превращения циклогептатриена-1,3,5 описываются схемой:
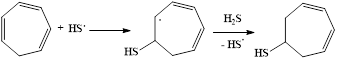
Образующийся тиол способен присоединять по кратной связи вторую тиогруппу:
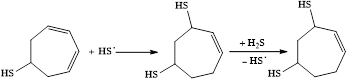
После полного насыщения субстрата, обусловленного восстановлением протона в условиях электролиза, происходит окисление тризамещенного циклогептана:
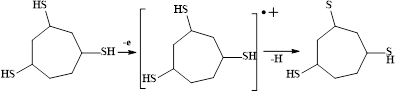
Сероцентрированный радикал димеризуется с образованием соответствующего дисульфида:
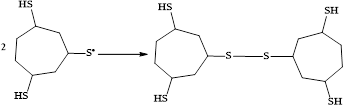
Параллельно с S-функционализацией ЦГТ протекают процессы гидрирования кратных связей, что обусловлено проведением электросинтеза в ячейке с неразделенным катодно-анодным пространством. За счёт восстановления на противоэлектроде катион-радикалов H2S и триена генерируется атомарный водород, участвующий в реакции гидрирования ненасыщенного карбоцикла. К тому же, ввиду высокой реакционной способности углеводорода в электрохимических условиях протекает его превращение в продукт ароматизации.

