Современные методы высокоточной доставки лекарственных средств
Журнал: Научный журнал «Студенческий форум» выпуск №6(6)
Рубрика: Медицина и фармацевтика

Научный журнал «Студенческий форум» выпуск №6(6)
Современные методы высокоточной доставки лекарственных средств
Возможность прицельной доставки лекарственных веществ при помощи наноконструкций, таких как: липосомы, наномицеллы, полимерные микросферы, симбиотические молекулы и другие, уже давно занимает умы ведущих ученых по всему миру. Такой интерес обусловлен особыми, высокоспецифичными свойствами, благодаря которым можно решить определенные проблемы, например: прицельная и точная доставка лекарств в любую точку тела пациента, преодоление естественных гистологических барьеров организма, повышение эффективности фармакокинетики. Однако каждая из них обладает определенными недостатками, накладывающими конкретные ограничения на их применение. Именно поэтому различные научные коллективы занимаются их разработкой и совершенствованием.
Так, например, ученые из Канады разработали метод доставки лекарственных веществ в труднодоступные участки опухолевого роста при помощи бактерий, чувствительных к магнитному полю и уровню кислорода. [3] Они использовали недавно открытую бактерию Magnetococcus marinus [1], а вернее её штамм MC-1. В её клетках содержатся особые органеллы, чувствительные к магнитному полю, – магнетосомы [5]. Но помимо этого, они также обладают чувствительностью к кислороду и способностью к активному передвижению. В естественных условиях они передвигаются вдоль магнитных линий, пока не достигнут зоны с пониженным содержанием кислорода, где и остаются – это оптимальные условия для их существования. Это может быть использовано для селективной доставки ими лекарств в зону гипоксии, вызываемой новообразованиями [7].
В условиях эксперимента ученые ввели иммунодефицитным мышам с карциномой из имплантированных клеток человека MC-1. После этого поместили животных в магнитное поле с фокусом на опухоли и удостоверились, что бактерии скапливались в зонах гипоксии.
На следующем этапе эксперимента MC-1 были нагружены липосомами с противоопухолевым препаратом SN-38 [6]. После введения липосомы распределились по всему объему опухоли, преимущественно в областях некроза и гипоксии. Уровень прицельного накопления превысил 50 процентов. При этом введение бактерий не вызвало выброса цитокинов и, соответственно, не вызывало воспаления и повреждения тканей животного.
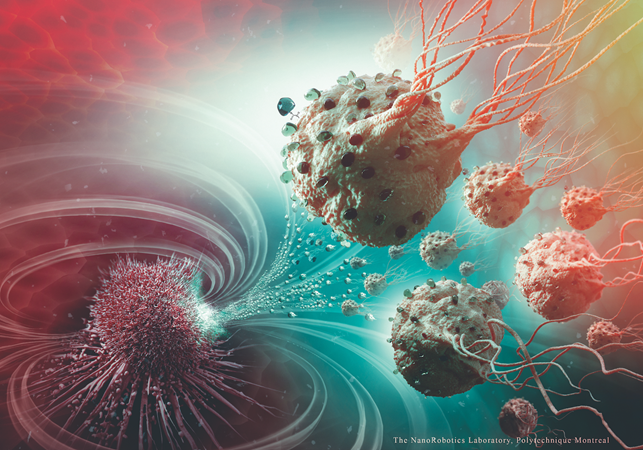
Рисунок 1. Иллюстрация атаки опухолевой клетки (Polytechnique Montréal)
Команда из Барселоны изобрела специальные «ковры» из магнитных частиц для переноса других частиц, не обладающих магнетизмом [4]. Эта работа может быть использована для точечной доставки немагнитных частиц, что в теории упростит этот процесс, поскольку в таких условиях возможна самосборка в листы с плотнейшей гексональной упаковкой.
Авторами использовались микросферы из полистирола и оксидов железа Fe2O3 и Fe3O4. Полученные молекулы суспендировали в тончайшем слое ферромагнетной жидкости между двумя стеклами и помещали полученный образец во взаимноперпендикулярные магнитные поля. Добавляя новое вращающееся в плоскости стёкол поле, ученые смогли добиться той самой самосборки молекул, а при изменении вертикального вектора поля частицы начинали перемещаться внутри самих групп, медленно перемещая их в жидкости как единое целое. Эксперимент проводился на одиночной клетке дрожжей, которую переместили на 90 микрометров, что почти в два раза превышает размеры всей группы частиц.
Главным достоинством своего метода авторы считают отсутствие необходимости дополнительной модификации частиц перед самосборкой. Стоит так же отметить, что принцип работы метода не ограничивается короткими цепями и, в перспективе, возможно создание сферы любого размера.

Рисунок 2. Микрофотография полученных структур
И, наконец, говоря о симбиотических молекулах, нельзя не упомянуть последние достижения авторов Австралии, Германии и США. Суть их работы заключается в модификации панциря диатомовых водорослей, которые используют как капсулы для точечной доставки противораковых препаратов к опухолевым клеткам [2]. Эти молекулы высокоспецифичны за счет антител к раковым клеткам, помещаемым на их поверхности методами генной инженерии.
Диатомовые водоросли не вызывают ответа иммунной системы из-за особого состава их панциря, а именно, оксида кремния в его составе. В центре панциря имеется полость, куда можно поместить лекарственные вещества, которые будут выходить в интерстиций через поры клетки. Особой медицинской ценностью данное семейство водорослей обладает за счет большого диапазона размеров клеток, поскольку размер пор напрямую связан с ним. Это позволяет максимально точно подобрать эффективную скорость диффузии препарата.
Для эффективной работы системы ученые генетически модифицировали диатомовую водоросль Thalassiosira pseudomonada, благодаря чему на её поверхности были закреплены фрагменты G белка, способные к связи с IgG. На такую поверхность возможно нанести антитела, специфичные к определенному белку. Белок G был выбран как универсальный «адаптор» для антител к различным типам клеток. На данном этапе прогресса эксперимента удалось достигнуть селективной адгезии капсул на B-лимфомы и нейробластомы.
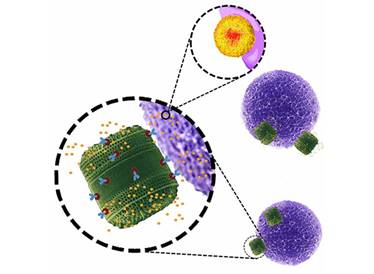
Рисунок 3. Модифицированный панцирь водоросли (зеленый) выпускает молекулы лекарства (желтый), связавшись с поверхностью раковой клетки (фиолетовый) (Bahman Delalat et al., Nature Communications)
Данная система доставки лекарств показывает наилучшие результаты как для токсичных веществ, коими большинство противоопухолевых препаратов и являются, так и для препаратов, плохо связываемых белками крови, от чего страдает скорость и точность доставки. Дополнительным плюсом этой технологии является простота получения конечного продукта: для создания крайне сложных микроскопических структур достаточно просто создать определенные условия для роста.
Таким образом, опираясь на вышеизложенную информацию, можно сделать вывод, что высокоточные методы доставки лекарственных средств действительно способны решить многие проблемы нынешней медицины в области фармакологии. Каждый метод обладает своими плюсами и минусами, но дальнейшие разработки и синтез полученной информации неизбежно приведет к качественным изменениям в этой области, что и ознаменует новую эру в медицине.

