Аортокоронарное шунтирование. Современные технологии в хирургии
Секция: Медицина и фармацевтика

X Студенческая международная научно-практическая конференция «Естественные и медицинские науки. Студенческий научный форум»
Аортокоронарное шунтирование. Современные технологии в хирургии
Аортокоронарное шунтирование (АКШ) – операция, представляющая вид хирургического лечения ишемической болезни сердца (ИБС), является одним из методов реваскуляризации миокарда, при помощи восстановления кровотока коронарного русла ниже места стеноза, путём создания шунтов от аорты к венечной артерии.
Своё начало АКШ берёт в 60-ые годы прошлого столетия, когда в 1967 году Рене Фоваларо, хирург Кливденской клиники в США провел первое аутовенозное шунтирование с искусственным кровообращением (ИК). Однако, ранее, 2 мая 1960 года Робертом Хансом Гёцом в США было сделано первое маммарокоронарное шунтирование.
В данной операции, в качестве шунта используется внутренняя грудная артерия (ВГА), несмотря на то, что этот метод был использован раньше на семь лет, он является методом выбора при шунтировании венечных артерий и "золотым стандартом" в шунтировании передней нисходящей артерии (ПНА), так как проходимость шунта через 10 лет сохраняется в 90-95 % случаев.
Данная операция выполняется давно, но кардиохирурги не утратили к ней своего интереса и улучшают её методику проведения, для достижения более положительных результатов.
Подобное хирургическое лечение ИБС показано пациентам в следующих случаях:
- Множественное поражение коронарного русла;
- стеноз ствола левой коронарной артерии;
- стеноз ПНА, при невозможности выполнения ангиопластики.
Конечно же, перед операцией необходимо обратить внимание на клиническую картину заболевания, проходимость коронарного русла в целом и состояние левого желудочка, зная обязательно его фракцию изгнания. Так же необходима консультация эндоваскулярного хирурга для решения вопроса о возможности проведения баллонной ангиопластики со стентированием, при поражении 1-2 сосудов.
У АКШ есть ряд осложнений в послеоперационном периоде. Одно из них - острая почечная недостаточность, особенно если в анамнезе имеются заболевания почек, требующая в дальнейшем трансплантации почек.
Следующее - это церебральные микроэмболии и острая недостаточность мозгового кровообращения (ОНМК), но цитируя J.W. Hammon: "истинное ишемическое нарушение мозгового кровообращения встречается относительно редко (<6%) и является верхушкой айсберга всех случаев нарушений мозгового кровообращения", поэтому у пациентов может наблюдаться стёртая картина перенесённого микроинсульта и ряд неврологичиских осложнений в виде: снижения интеллекта, ажитации, дефицита памяти, дезориентации, снижении порога судорожной готовности мозга, спутанности сознания и др.
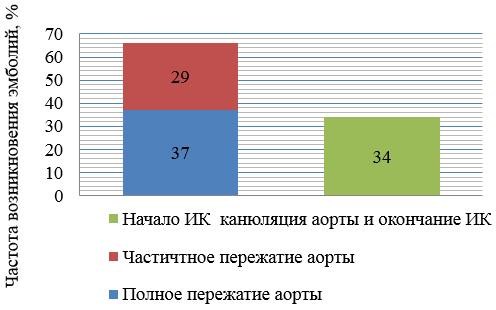
К кардиологическим осложнениям относится: инфаркт миокарда, фибрилляция предсердий или желудочков. Возможен и ряд инфекционных осложнений: кардиты различной этиологии, в частности ревматический, пневмонии, плевриты и эмпиема плевры, нагноение раны и сепсис. Все эти осложнения возникают благодаря подключению пациентов во время операции к аппарату искусственного кровообращения (АИК) и пережатию аорты зажимом, порой больше чем на 70 минут, с последующим наложением зажима для пристеночного отжатия восходящей аорты (Таблица 1.), а так же из-за, длительного проведения операции и гемотрансфузий во время неё.
Данный ряд осложнений и полиморбидные состояния многих пациентов, имеющие в последнее время тенденцию к увеличению количества имеющихся заболеваний, с вытекающими из этого высокими рисками хирургического лечения ИБС, способствовали созданию современных технологий проведения АКШ.
Таблица 1.
Влияние ИК и пережатия аорты на возникновение эмболий
Один из современных методов проведения операции считается АКШ на работающем сердце (Off-pump coronary artery bypass - OPCAB). Он заключается в том, что доступ к сердцу осуществляется традиционным способом, путём срединной стернотомии, но при этом подключения АИК, остановки работы сердца и введение кардиоплегического раствора не происходит. После ревизии сердца и выбора мест для шунтирования, используют специальные инструменты для наложения проксимального анастомоза без бокового пережатия восходящей аорты. Сначала делается отверстие в стенке сосуда перфоратором аорты, закрывая отверстие пальцем, устанавливается обтуратор, создающий гемостаз, с помощью доставляющего устройства (Heartstring) в перфорацию аорты, после чего удаляется доставляющее устройство и выполняется наложение анастомоза, при этом узел не затягивается и ослабляется 2 стежка для формирования свободной петли. Затем обтуратор удаляют, потянув за его нить, и заканчивают формирование анастомоза. Данная методика позволяет хирургу отказаться от частичного пережатия аорты, снижая тем самым риск тромбоэмболии артерий головного мозга с улучшением качества отдалённых результатов операции. После чего устанавливают устройство для позиционирования верхушки сердца (к примеру, Xpose), создавая тем самым его необходимую экспозицию. Путём фиксации ткани вакуумным разряжением специальной присоской, оно создаёт хорошую фиксацию без повреждения миокарда, используя вакуум не более 250 мм рт. ст., сохраняя при этом нормальные сокращения сердца, стабильную гемодинамику и хороший доступ к различным артериям коронарного русла. Далее накладывают систему для стабилизации миокарда в месте будущего шунтирования необходимой артерии. Для этой манипуляции существует ряд устройств, создающие фиксацию путём механического давления (такие как CTS, USSC), или наложения швов-держалок (Genzyme), или опять же создания вакуумного разряжения (Acrobat или Octopus), последний является самым современным приспособлением. Он обеспечивает атравматичную и надёжную фиксацию миокарда, без затруднений доступа к необходимой артерии, с помощью специальной подвижной лапки с вакуумными присосками.
Следующий этап - это формирование дистального анастомоза с коронарной артерией. Для того что бы снизить кровопотерю и создать бескровное операционное поле с сохранением кровоснабжения миокарда после вскрытия артерии, используется специальный временный атравматичный шунт (к примеру, Axius coronary shunt), который устанавливается в просвет сосуда, далее накладывают анастомоз и не затягивая узла удаляют шунт, заканчивая наложение анастомоза. Так же для создания хорошей видимости в местах наложения швов используется специальный сдуватель ( Axius Blower Mister), создающий контролируемую подачу СО2 и физиологического раствора.
Использование данных технологий, позволяет проводить АКШ без АИК, тем самым, уменьшается количество осложнений у пациентов (таблица 2.).
Таким образом, благодаря внедрению ряда современных приспособлений в кардиохирургию, можно избежать нежелательных последствий или снизить процент различных осложнений в послеоперационном периоде, которые были перечислены выше.
Таблица 2.
Снижение количества осложнений по сравнению с АКШ с АИК

Следующий современный метод - миниинвазивный (Minimally Invasive Direct Coronary Artery Bypass Grafting - MIDCABG). Он так же выполняется на рабочем сердце, с использованием таких же вакуумных стабилизаторов миокарда и верхушки сердца. Отличие заключается в том, что доступ к сердцу осуществляется левосторонней передней мини-торакатомией в V межреберье начиная от левого края грудины и заканчивая на 1см ниже и правее соска. Анастомоз накладывается только на ПНА путём маммарокоронарного шунтирования с помощью левой ВГА. Для операции используют специальную модульную систему (MIRA-i) для обеспечения хорошего и атравматичного доступа к необходимому участку миокарда. Для выделения ВГА используют рентгенпрозрачные пластины для позиционирования необходимой артерии, что обеспечивает экономию времени в течение операции.
Преимущества данной методики заключаются в том, что миниинвазивный метод позволяет хирургу осуществить доступ к сердцу, менее травматичным путём, что влияет на динамику течения раны, сроки госпитализации и послеоперационный период. Данный метод позволяет начинать раннюю активизацию пациентов через значительно меньшие сроки. Количество и частота различного рода послеоперационных осложнений становится намного меньше. Относительным недостатком методики является возможность шунтирования только ПНА и её ветвей, поэтому к такой операции прибегают при невозможности ангиопластики ПНА.
Самая современная методика проведения АКШ - это робот-ассистированная операция (Totally endoscopic coronary artery bypass - TECAB), которая проводится с помощью робота-хирурга (Da Vinci и других аналогов). В данном случае возможно шунтирование при значимом проксимальном поражении ПНА, в сочетании с поражением других артерий и с возможностью стентирования. А так же при значимом остиальном поражении правой коронарной артерии (ПКА), бифуркационном поражении ПНА и диагональных ветвей (ДВ), изолированном стволовом поражении левой коронарной артерии (ЛКА), поражении ПНА и ветвей тупого края (ВТК), поражении ЛКА, поражении эквивалентном стволовому со стенозом ПКА с возможным стентированием.
Во время операции порты для роботизированных инструментов вводятся в левую часть грудной полости, но прежде всего для этого необходимо вместе с анестезиологом достичь полного коллапса левого лёгкого. В один из портов устанавливается камера, затем инсуффлитируется СО2 под давлением 8 мм рт. ст. Далее совершается ревизия грудной полости и устанавливаются другие инструменты. Затем приступают к выделению ВГА при помощи электрокоагулятора и щипцов. В дальнейшем осуществляют шунтирование необходимой артерии.
Данная операция может выполняться и гибридным способом, то есть в то время, когда происходит формирование анастомоза, могут проводить баллонную ангиопластику со стентированием какой-либо ветви, либо же эндоваскулярное вмешательство могут провести сразу же после операции.
У данной методики большое количество преимуществ и прежде всего они заключаются в снижении частоты послеоперационных осложнений, благодаря тому, что операция проводится без АИК. Однако, существует методика проведения данного вмешательства и с подключением АИК, путём канюляции бедренной артерии и вены.
Операция выполняется быстрее данным способом, что так же положительно влияет на отдалённые результаты. Сроки госпитализации и длительность послеоперационного периода снижены даже в сравнении с OPCAB и MIDCABG, а так же мала вероятность ОПН и ОНМК (Таблица 3.). Меньше послеоперационный рубец и сроки заживления раны, что имеет неоспоримое преимущество в ведении пациентов с сахарным диабетом, хронической артериальной и венозной недостаточностями.
Снижение кровопотери, соответственно необходимость в гемотрансуфузиях тоже снижается.
Так же возможна ранняя активизация пациентов и начало привычной физической активности (2-3 неделя после операции).
Возврат стенокардии через несколько лет минимален.
Таблица 3.
Результаты робот-ассистированного АКШ без использования АИК
|
Авторы и ссылки |
Операции |
Периоперационная смертность |
Ревизия кровотечений |
Инсульт |
ОПН |
Госпитализация (дни) |
|
De Canniere и др. |
117 |
2 |
- |
- |
- |
- |
|
Kappert и др. |
3 |
0 |
- |
- |
- |
6±1 |
|
Boyd и др. |
6 |
0 |
- |
- |
- |
8,6±2,7 |
|
Loisance и др. |
13 |
1 |
- |
- |
- |
- |
|
Srivastava и др. |
108 |
0 |
1 |
0 |
1 |
3,4±2,0 |
|
Srivastava и др. |
241 |
0 |
2 |
1 |
1 |
- |
|
Всего n, (%) |
488 |
3/488 (0,6) |
3/334 (0,3) |
1/334 (0,3) |
2/334 (0,3) |
- |
Итак, современные методики АКШ на данном этапе позволяют достичь очень хороших результатов, прежде всего благодаря отказу от АИК и пережатия аорты, что позволяет добиться меньшей инотропной поддержки, сниженной необходимости в интрааортальной баллонной контрпульсации, уменьшения смертности определенных подгрупп пациентов. Низок риск церебральных микроэмболий и ОНМК, послеоперационная динамика в целом намного лучше. Так же сокращено время пребывания пациентов в больнице.
Немаловажным является менее выраженный послеоперационный рубец. Возможность избежать различного рода осложнений и более быстрого выздоровления пациентов, позволяет проводить хирургическое лечение ИБС более широкому кругу людей с повышенными факторами хирургического риска.





