СОВРЕМЕННЫЕ МЕТОДЫ ЛЕЧЕНИЯ, ПОДДЕРЖАНИЯ БОЛЕЗНИ, СИНДРОМА МАЛЬАБСОРБЦИИ «ЦЕЛИАКИЯ» У ВЗРОСЛЫХ»
Секция: Медицина и фармацевтика

XLVIII Студенческая международная научно-практическая конференция «Естественные и медицинские науки. Студенческий научный форум»
СОВРЕМЕННЫЕ МЕТОДЫ ЛЕЧЕНИЯ, ПОДДЕРЖАНИЯ БОЛЕЗНИ, СИНДРОМА МАЛЬАБСОРБЦИИ «ЦЕЛИАКИЯ» У ВЗРОСЛЫХ»
Аннотация. Представлены сравнительная характеристика и диагностические алгоритмы целиакии, аллергии к пшенице и непереносимости глютена с учетом клинических, иммунологических, морфологических и генетических особенностей каждой из перечисленных нозологических форм. Рассмотрена рефрактерная целиакия. При целиакии определяются специфические антитела к тканевой трансглутаминазе, антиэндомизиальные антитела, при биопсии выявляется атрофия слизистой оболочки тонкой кишки. При неаутоиммунной неаллергической непереносимости глютена больные с клинической картиной целиакии, однако при биопсии морфологические изменения не выявляются, также не изменяются специфичные для целиакии антитела. Чувствительность к глютену встречается не только при целиакии, а в ряде заболеваний, которые требуют мультидисциплинарного подхода и тщательного анализа анамнеза, клинических и лабораторных данных.
Ключевые слова: целиакия; аутоиммунное состояние; трансглутаминаза; антитела; энетерит.
ВВЕДЕНИЕ
Целиакия – энтеропатия, обусловленная развитием неадекватной иммунной реакции в ответ на поступление глютена – белкакомпонента клейковины злаковых продуктов в просвет тонкой кишки, заболевание, сопровождающееся атрофией ворсин слизистой оболочки тонкой кишки, развитием мальабсорбции на фоне употребления в пищу глютенсодержащих продуктов. Заболевание описано во II веке нашей эры греческим врачом Аретеем (Aretaeus of Cappadocia) и было названо “koeliakos” (греч. – "страдание кишечника"). Распространенность целиакии существенно отличается в разных странах мира, в среднем составляя 0,5-1,0% от общего числа населения планеты. Значительный разброс показателей объясняется высокой частотой скрытых и атипичных форм заболевания – 7-10 случаев на 1 диагностированный. Большинство больных являются носителями мутировавшего лейкоцитарного гена DQ2/DQ8.
Главным инициирующим фактором целиакии являются глютены (группа растительных белков фракций проламинов и глютелинов, содержащихся в злаковых). У генетически предрасположенных людей эти протеины вызывают неадекватную реакцию слизистой оболочки тонкой кишки. Заболевание наследуется по аутосомнодоминантному типу.
Чаще всего (91%) повреждаются аллели HLA-DR3 и HLA-B8 (dq6) . Механизмы манифестации заболевания остаются невыясненными. В литературе активно обсуждаются две теории развития болезни – иммунная и токсическая. У больных целиакией наблюдается недостаток ферментов: глутамин-специфической цистеин эндопротеазы и пролил эндопептидазы.
Полагают, что в результате нарушения метаболизма в просвете кишки накапливается глютен и его недоращепленные продукты (фракции глиадина), оказывающие прямое токсическое действие на энтероциты, следствием чего является атрофия слизистой тонкой кишки и развитие симптомов целиакии. Эта теория подтверждается полным восстановлением слизистой оболочки тонкой кишки на фоне аглютеновой диеты, эффективностью применяемой в последние несколько лет ферментотерапии. Другая распространенная теория — иммунологическая. После всасывания в слизистой тонкой кишки глиадины подвергаются дезамидированию (фермент — тканевая трансглутаминаза).
В результате мутации в гене HLA-1, дезамидированный глиадин как антиген способен активировать иммунный ответ организма. Через Т-клеточный рецептор (TCR) активируются CD4+, CD8+ Т-лимфоциты, запускается цитокиновый каскад, индуцируется апоптоз энтероцитов и продукция антител.
Пусковыми цитокинами целиакии являются NF-kB, INF-γ, IL-15. Глиадин опосредованно вызывает фосфолирирование ингибитора NF-kB (Nuclear Factor kappaB), что приводит к активации последнего. NF-kB запускает экспрессию провоспалительных цитокинов и молекул адгезии (рис 1). В результате местно развивается реакция воспаления. INF-γ вызывает выброс ферментов (например, матриксной металлопротеиназы), повреждающих энтероциты, провоспалительных цитокинов, снижение синтеза иммуноглобулина А.IL-15 активирует межэпителиальные лимфоциты. Фракция представлена TCRγδ CD4+, CD8+, CD56+, CD103+ T-лимфоцитами. После активации клетки приобретают цитотоксичность, экспрессируют провоспалительные цитокины (IL-2,-7,-8,-15), индуцируют апоптоз энтероцитов. Межэпителиальные лимфоциты регулируют целостность плотных контактов (tight junction) кишечного эпителия: γ,δ цепи TCR участвуют в фосфорилировании сериновых остатков окклюдина . В результате перестройки цитоскелета повышается проницаемость эпителия и увеличивается проникновение глиадина в собственную пластинку слизистой. Запускается каскад антителообразования: Т-клетки выступают в роли антигенпрезентирующих клеток для В-лимфоцитов, вырабатывающих антитела к глиадину. Образуются перекрестные антитела к тканевой трансглутаминазе, эндомизию.
Антитела к трансглутаминазе имеют сродство к Toll-like рецепторам 4 типа (TLR4) на поверхности межэпителиальных лимфоцитов. Комплексы антиген-антитело вызывают повреждение энтероцитов. На их поверхности начинается экспрессия MICA, MICB – рецепторов, активирующих межэпителиальные лимфоциты. Таким образом местная воспалительная реакция генерализуется. Вместе с тем запускается каскад системных аутоиммунных реакций (тиреоидит, сахарный диабет первого типа, дерматит) и развитие заболевания приобретает молниеносный характер.
Диагностика целиакии длительное время была трудна и основывалась на клинических наблюдениях. Значимые симптомы (в приоритетном порядке): хроническая диарея, атаксия, анемия, герпетиформный дерматит, повышение трансаминаз, эпилепсия, бесплодие, периферическая нейропатия, рецидивирующий перикардит, потеря веса, диабет первого типа или патологии щитовидной железы в анамнезе, семейный анамнез целиакии, недостаточность IgA, осеопороз, снижение D-ксилозы, частый кариес. С развитием медицинских технологий широкое применение нашли серологические и генетические методы исследования. Биопсийное исследование – «золотой стандарт» диагностики целиакии. В 1969 году Европейским обществом гастроэнтерологов приняты диагностически значимые морфологические критерии целиакии: высота кишечных ворсинок менее 200 мкм (норма 270-300 мкм), гипертрофия и увеличение глубины крипт до 250- 600 мкм, увеличение числа межэпителиальных лимфоцитов более 40 на 100 эпителиоцитов, лимфо-плазмоцитарная инфильтрация собственной пластинки. В 1990 году при пересмотре в перечень ранее установленных критериев диагноза включена эффективность аглютеновой диеты. Гистологическая классификация предложена Маршем и предусматривает выделение четырех стадий развития болезни. В 1999 Oberhuber G. с соавт. предложили более детальную градацию III стадии. Используемая в настоящее время версия классификации Marsh (Marsh-Oberhuber приложение №2), приводится ниже:
Marsh I стадия (воспалительная) – структура слизистой оболочки не изменена, наблюдается лимфоцитарная инфильтрация подслизистой, увеличение числа межэпителиальных лимфоцитов на верхушке ворсинок;
Marsh II стадия (лимфоцитарный энтерит) – гиперплазия крипт, укорочение ворсинок, увеличение числа митозов, изменение соотношение крипта/ворсинка меньше 1:3–1:5;
Marsh III стадия (деструкция) – атрофия ворсинок;
Marsh IIIA стадия – парциальная атрофия ворсинок, соотношение крипта/ворсинка меньше 1;
Marsh IIIB стадия – субтотальная атрофия ворсинок;
Marsh IIIC стадия – тотальная атрофия ворсинок, слизистая оболочка тонкой кишки напоминает слизистую оболочку толстой кишки («кишечник-труба»);
Marsh IV стадия (гипопластическая атрофия) – необратимая атрофия с резким истончением слизистой оболочки тонкой кишки. Наблюдается крайне редко. В литературе обсуждается мнение, что IV стадия целиакии представлена изменениями, развившимися на фоне Тклеточной лимфомы – редкого осложнения тяжелого течения заболевания. Предположительно пусковым механизмом развития лимфомы является гиперсекреция IL-15. В место воспаления привлекаются активированные межэпителиальные лимфоциты (Т-киллеры), из которых строится опухоль. В 2005 г. G.R. Corazza, V. Villanacci предложена принципиально новая трехстадийная система классификации заболевания (рис. 3), в основу которой положены относительные величины (соотношение высоты ворсинок и глубинны крипт приложение №1).

Рисунок 2. Классификация целиакии по Corazza (приложение №1)
Классификация Corazza не отражает пато- и морфогенеза (стадийности) заболевания, однако простота, лаконичность и удобство использования ее обеспечивают постепенное вытеснение классификации Marsh. Несмотря на активные исследования патогенеза целиакии, остается немало вопросов. Каков механизм манифестации заболевания? Почему при соблюдении аглютеновой диеты стойкая аутоиммунная реакция подвергается обратному развитию? Как происходит восстановление ультрамикроскопической структуры эпителия? Какую роль в патогенезе заболевания играют межэпителиальные лимфоциты? Возможна ли полноценная заместительная ферментная терапия? На некоторые из них постараемся найти ответ ниже.
1.1. Межэпителиальные лимфоциты при целиакии.
Межэпителиальные лимфоциты регулируют целостность плотных контактов (tight junction) кишечного эпителия: γ,δ цепи TCR участвуют в фосфорилировании сериновых остатков окклюдина. В результате перестройки цитоскелета повышается проницаемость эпителия и увеличивается проникновение глиадина в собственную пластинку слизистой.
Запускается каскад антителообразования: Т-клетки выступают в роли антиген-презентирующих клеток для В-лимфоцитов, вырабатывающих антитела к глиадину. Образуются перекрестные антитела к тканевой трансглутаминазе, эндомизию.
Антитела к трансглутаминазе имеют сродство к Toll-like рецепторам 4 типа (TLR4) на поверхности межэпителиальных лимфоцитов. Комплексы антиген-антитело вызывают повреждение энтероцитов. На их поверхности начинается экспрессия MICA, MICB - рецепторов, активирующих межэпителиальные лимфоциты. Таким образом местная воспалительная реакция генерализуется. Вместе с тем запускается каскад системных аутоиммунных реакций (тиреоидит, сахарный диабет первого типа, дерматит) и развитие заболевания приобретает молниеносный характер.
ТИПИЧНАЯ ЦЕЛИАКИЯ (механизм манифестации заболевания).
В типичном случае целиакия обычно манифестирует через 2-4 месяца после введения злаковых продуктов в питание, как правило, в 8-10-месячном возрасте ребенка. Манифестация целиакии возможна после инфекционного заболевания (кишечной инфекции, ОРВИ), которое является провоцирующим фактором, а также без связи с каким-либо заболеванием или состоянием.
Первыми симптомами типичной целиакии являются эмоциональная лабильность, снижение аппетита, замедление темпов прибавки массы тела. Стул становится обильным, зловонным, обычно кашицеобразным, гомогенным, жирным.
Характерные симптомы:
учащение стула, полифекалия, стеаторея, увеличение окружности живота на фоне снижения массы тела или недостаточных прибавок, признаки гипотрофии (снижение массы тела, истончение подкожного жирового слоя), снижение мышечного тонуса, утрата ранее приобретенных навыков и умений, иногда гипопротеинемические отеки.
Возможны многообразные дефицитные состояния: рахитоподобный синдром, синдром остеопении, боли в костях ночные и при физической нагрузке, патологические переломы костей, судорожный синдром, поражение зубной эмали, кариес зубов, раздражительность, агрессивное поведение, неспокойный сон, анемия, полиурия, полидипсия, дистрофические изменения и ломкость ногтей, повышенная кровоточивость от мелкоточечных кровоизлияний до тяжелых носовых и маточных кровотечений, нарушение сумеречного зрения, фолликулярный гиперкератоз, витилиго, стойкие фурункулезы, хейлиты, глосситы, рецидивирующие стоматиты, парестезии с потерей чувствительности, периферическая нейропатия, обмороки, упорные головные боли, выпадение волос.
Атипичная целиакия характеризуется атрофией слизистой оболочки тонкой кишки, наличием серологических маркеров, однако клинически проявляется какими-либо отдельными симптомоми из перечисленных выше при отсутствии прочих. Чаще встречаются варианты атипичной целиакии с ведущим анемическим синдромом, с остеопоро-зом, с задержкой в росте. Атипичная целиакия характерна для детей более старшего возраста.
При латентной целиакии определяются серологические маркеры, но клинические признаки заболевания отсутствуют, атрофия слизистой оболочки тонкой кишки отсутствует или имеет слабую степень выраженности. Часто наблюдается у родственников больных целиакией. Как показывают последние эпидемиологические данные, латентная целиакия широко распространена в европейской популяции.
В течении целиакии выделяют активный период и период ремиссии. Длительность и стойкость ремиссии определяется строгостью соблюдения безглютеновой диеты. Практически возможен вариант с единственным активным периодом и последующей многолетней ремиссией.
По данным зарубежных исследователей, при длительном течении нераспознанной целиакии повышается риск возникновения опухолей желудочно-кишечного тракта и другой локализации, а также ассоциированных с целиакией аутоиммунных заболеваний.
1.2. РЕФРАКТЕРНАЯ ЦЕЛИАКИЯ.
Рефрактерная целиакия (РЦ) - может быть определена как персистирование или рецидив клинических симптомов заболевания, наличие атрофии ворсинок с гиперплазией крипт СО тонкой кишки и увеличение количества межэпителиальных лимфоцитов (МЭЛ), несмотря на строгое соблюдение АГД в течение 6 – 12 месяцев, при отсутствии других причин. Пациенты с РЦ могут не ответить на АГД как при первичном назначении терапии, так и вторично. Специфическое определение РЦ отсутствует в научной литературе. Точная распространенность РЦ в популяции не известна, однако именно РЦ может быть основной причиной персистирования и рецидивирования симптомов заболевания у пациентов, находящихся на строгой АГД. При обсуждении диагноза РЦ должны быть исключены все возможные причины нарушенного всасывания, при наличии серологических и генетических HLA-DQ маркеров заболевания. В настоящее время признаны два типа РЦ: тип I без аберрантных Т-клеток и тип II с аберрантными Т-клетками, обнаруженными с помощью иммунофенотипирования (проточный цитометрический анализ) или иммуногистохимии СО тонкого кишечника. Приблизительно количество аберрантных клеток в количестве 10% считается в пределах нормы, свыше 20% определенно признаком заболевания. Диагностические критерии РЦ РЦ 1 типа: сохраняющаяся или рецидивирующая атрофия ворсинок, несмотря на строгое соблюдение АГД; атрофия ворсинок по модифицированным критериям Marsh соответствует как минимум стадии Marsh 3А; исключены другие причины причин атрофии ворсинок; наличие 10% аберрантных Т-клеток в биопсии тонкого кишечника; МЭЛ фенотип с нормальными уровнями CD3, CD8 и Т-клеточных рецепторов. РЦ 2 типа: те же критерии, что и при РЦ 1 типа, но требуется наличие более 20% аберрантных Т-клеток в биопсии тонкого кишечника; МЭЛ имеют нормальную морфологическую картину, но присутствует аберрантный фенотип (нормальная экспрессия CD103 и CD7, и отсутствие поверхностных Т-клеточных маркеров CD4, CD8 и Т-клеточных рецепторов); энтеропатия, обусловленная Т-клеточной лимфомой, должна быть исключена. Стойкая диарея, боли в животе, и потеря массы тела являются наиболее распространенными симптомами РЦ. Также зачастую данное заболевание сопровождают витаминная недостаточность, анемия, утомляемость, недомогание, эпизоды тромбоэмболий и аутоиммунные заболевания.
Большинство пациентов с РЦ диагностируются на этапе присоединения новых симптомов после положительного клинического ответа на АГД в течение многих лет («вторичная» РЦ). Тем не менее, у части пациентов РЦ в связи с отсутствием эффекта от АГД может диагностироваться рано в течение первых 6-12 месяцев («первичная» РЦ). На момент диагностирования РЦ специфические серологические маркеры (эндомизиальные антитела или антитела к тканевой трансглутаминазе) у большинства пациентов могут быть отрицательные, что говорит лишь о строгом соблюдении АГД. Положительные серологические маркеры могут присутствовать у 19-30% пациентов с РЦ, несмотря на строгое соблюдение АГД, и в данном случае положительная серология не должна исключать диагноза РЦ. Стандартная верхняя эндоскопия и видеокапсульная эндоскопия не являются «золотым» стандартом они лишь показывают макроскопические особенности СО тонкой кишки - атрофию ворсинок и/или язвенные дефекты. Тем не менее, эрозии и/или язвенные дефекты СО обнаруженные у пациентов с выраженной симптоматикой не всегда могут быть связаны с возникновением РЦ, большую роль в данном случае играют назначенные нестероидные противовоспалительные препараты и глюкокортикоиды. Язвенные дефекты тощей кишки в сочетании с размером дефекта более > 1 см являются характерными признаками для РЦ 2 типа. Присутствие изъязвлений нодулярной СО и формирование стриктур может предполагать наличие злокачественных осложнений.
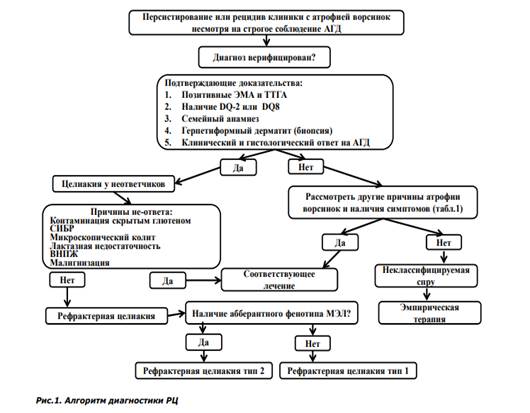
Рисунок 1. Алгоритм диагностики РЦ
Двойная балонная энтероскопия помогает в данном случае эффективноно диагностировать и исключать воспалительные процессы и язвенные дефекты при Т-лимфоме в тонком кишечнике у пациентов с РЦ. Верификация диагноза РЦ требует тщательной оценки клинических и морфологических данных. Диагноз базируется на основании убедительных доказательств, дополненных исключением других причин возникновения атрофии ворсинок и злокачественных новообразований (табл.1). Хотя РЦ является диагнозом исключения, она подтверждается объективными результатами лабораторных и гистологических исследований. Первым шагом в оценке потенциальных случаев РЦ является подтверждение правильности первоначального диагноза целиакии. Негативная серология на момент рассмотрения вопроса о наличии РЦ не исключает диагноза целиакии, в отличие от статуса HLA-DQ, отсутствие которого дает право исключить данный диагноз. Необходимо также провести тщательную проверку предыдущих исследований (серологических, морфологических, генетических) имевших решающее значение для верификации диагноза на начальном этапе. При наличии доказательного диагноза целиакии - следующим этапом является пересмотр всех причин, приводящих к возврату симптомов заболевания и плохого ответа на АГД (рис. 1). При установлении диагноза РЦ требуется госпитализация для контроля АГД, коррекции нутритивного статуса и лечения осложнений. Полное парентеральное питание, как правило, необходимо у 28 - 60% пациентов с РЦ из-за выраженного синдрома мальабсорбции, угрожающего дефицита массы тела и других проявлений синдрома нарушенного всасывания. Концепция лечения РЦ основана на рассмотренных клинических случаях, открытых обсервационных или проспективных исследованиях. Рандомизированные клинические исследования не проводились в виду редкой встречаемости РЦ. Кроме того, диагностические критерии для РЦ изменились, и к вопросу о лечении необходимо подходить с осторожностью, так как нет четкого разграничения между РЦ и другими рефрактерными спру. Для индукции клинической ремиссии и восстановления СО у большинства пациентов с РЦ 1 типа считается клинически эффективным назначение преднизолона (0.5 - 1 мг/кг/сутки), будесонида (9 мг/сут), или сочетание преднизолона и азатиоприна (2 мг/кг/ сут). Клинический ответ на стероиды наблюдается в большинстве случаев у пациентов с РЦ 2 типа, однако восстановление слизистой не ускоряется. Клинический ответ на будесонид при РЦ является клинически оправданным из-за его эффектов, хорошей переносимости и низкой частоты серьезных нежелательных явлений после кратковременного использования. Также было описано клиническое и гистологическое улучшение почти у 61% пациентов с РЦ после приема циклоспорина (5 мг/кг/сут). Другие иммунодепрессанты или биологические препараты использовались у стероид-зависимых пациентов, включая инфликсимаб (5 мг/кг/сут), и алемтузумаб (30 мг два раза неделю на 12 недель), хотя публикаций об успешно пролеченных больных меньше, чем неудач. Роль хирургии в лечении РЦ ограничена лечением таких осложнений, как перфорация, массивное кровотечение, непроходимость и онкопатология тонкого кишечника.
1.3. ЦЕЛИАКИЯ: СОВРЕМЕННЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ.
Увеличение числа случаев целиакии в последние годы обусловлено изменившимися подходами к диагностике этого заболевания. В данное время помимо типичной формы целиакии, протекающей с диареей, дистрофией, отставанием в развитии с раннего детского возраста в ответ на приём злаковых, в клинической картине заболевания принято выделять латентную и атипичную формы. Латентная форма, по мнению А.И. Парфёнова и соавт. (2005), встречается у 68,4% больных. Клинически она проявляется во взрослом возрасте в виде хронической диареи, похудания и других признаков мальабсорбции. Атипичная форма, по сообщению тех же авторов, определяется у 28,8% больных и характеризуется анемией, аутоиммунными, эндокринными нарушениями, бесплодием. Классические кишечные симптомы заболевания у больных в последнем случае слабо выражены, либо вообще отсутствуют. Кроме того, данными исследователями были предложены ещё несколько форм целиакии: - торпидная (рефрактерная) – отсутствует эффект от обычного лечения, для стабилизации состояния необходимо применение глюкокортикоидных гормонов; - бессимптомная (скрытая) – симптомы мальабсорбции отсутствуют, при инструментальном исследовании определяют гиперрегенераторную атрофию и/или увеличенное количество межэпителиальных лимфоцитов; - потенциальная – увеличено число межэпителиальных лимфоцитов и число митозов в клетках крипт, выявляется экспрессия HLA класса II. Постановка диагноза целиакии, а особенно констатирование её нетипичных форм, представляет собой трудную задачу. Решение последней на современном этапе стало возможным во многом благодаря разработке серологических маркеров целиакии. В настоящее время имеются лабораторные методики определения уровня антиглиадиновых антител, антител к эндомизию, ретикулину и тканевой трансглутаминазе. Выявление антиглиадиновых антител – недорогой высокочувствительный метод, используемый для диагностики целиакии в группах с высоким риском болезни, в общей популяции, однако, он не считается высокоспецифичным для целиакии. Метод обнаружения антител к ретикулину и эндомизию высокочувствительный и высокоспецифичный, но его отрицательной стороной является техническая сложность получения материала от приматов и высокая стоимость. Учитывая, что тесты с эндомизием оказываются высокочувствительными и высокоспецифичными, была разработана методика выявления антител к тканевой трансглутаминазе – основному антигену эндомизия. Последние серологические тесты считаются строго специфичными для целиакии, тем не менее, окончательный 30-40 лимфоцитов на 100 поверхностных энтероцитов); - Marsh-II (лимфоцитарный энтерит) – увеличение числа лимфоцитов, гиперплазия крипт, соотношение глубины крипт к высоте ворсинок составляет 1:3 – 1:5; - Marsh-III (деструкция) – атрофия ворсинок; - Marsh-III А (парциальная атрофия ворсинок) – частичная атрофия ворсинок с соотношением глубина крипт к высоте ворсинок менее 1; - Marsh-III В (субтотальная атрофия ворсинок) – выраженная атрофия ворсинок, однако, отдельные из них ещё распознаваемы; - Marsh-III С (тотальная атрофия ворсинок) – полная атрофия ворсинок; - Marsh-IV (гипопластическая атрофия) – резкое истончение слизистой оболочки, патологическая моноклональная инфильтрация Т-лимфоцитами (гистологически соответствует Т-клеточной лимфоме). Традиционно диагноз целиакии устанавливается при обнаружении патологических изменений, соответствующих Marsh-III. В то же время, необходимо учитывать, что у многих больных вследствие атипичности заболевания имеет место глютенчувствительное воспаление без атрофии ворсинок. Принципиальной особенностью гиперрегенераторной атрофии при целиакии является способность к восстановлению структуры после исключения глютена из пищевого рациона. Поэтому основа лечения заболевания – аглютеновая диета (АГД). Под её влиянием нивелируются кишечные симптомы, исчезают или уменьшаются аутоиммунные проявления, связанные с целиакией (остеопороз, экзема, герпетиформный дерматит и т.д.), снижается вероятность развития язвенного еюноилеита, энтерогенного сепсиса, злокачественных опухолей. Строгая АГД назначается пожизненно. Даже случайное употребление небольшого количества глютена (0,06-2 г/дн) приводит к изменению гистологической картины тонкого кишечника – увеличивается объём и глубина крипт, увеличивается число интраэпителиальных лимфоцитов. Первые положительные результаты АГД появляются уже в течение месяца от назначения, однако, у некоторых больных они отмечаются через полгода. диагноз болезни должен быть обязательно подтверждён гистологическим исследованием слизистой оболочки тонкой кишки [6]. Биопсию тонкой кишки следует выполнять и при нормальных титрах серологических маркеров в случаях обоснованного клинического подозрения на наличие целиакии. Характерные для целиакии морфологические изменения тонкой кишки описаны M.N. Marsh и представлены в форме патоморфологической классификации целиакии: - Marsh-I (предвоспалительная стадия) – структура слизистой оболочки нормальная, но с повышенным проникновением лимфоцитов в эпителиальный слой ворсинок (более
Необходимо отметить, что соблюдение АГД предполагает исключение из рациона продуктов, содержащих не только явный, но и скрытый глютен (табл.ниже). Маркировка продуктов со скрытым глютеном может отсутствовать. Это обусловливает неосознанное нарушение больными АГД. В настоящее время выпускаются безглютеновые продукты, имитирующие хлеб, муку, полуфабрикаты для выпечки, крупы, печенье, макаронные изделия и др. Специальные безглютеновые продукты обычно имеют маркировку в виде перечеркнутого колоска и/или надписи Gluten-free, или «Не содержит глютена». Основными производителями таких продуктов, представленных на российском рынке, являют ся компании Schar GmbH (Италия), Glutano (Pauli Bisquit GmbH, Германия), Finax AB и Semper (Швеция). В настоящее время появляются специализированные продукты для больных целиакией и отечественного производства, хотя их ассортимент пока остается скудным. При ведении больных с целиакией необходимо учитывать, что глютен может попадать в организм больного с непищевыми продуктами – клей на почтовых марках и конвертах, некоторые сорта зубной пасты, косметики, в том числе губной помады, и др. К сожалению, производители этих товаров обычно не указывают в их составе о наличии глютена. Поэтому необходимо регулярно информировать больных с целиакией о непищевых продуктах, содержащих глютен, с тем, чтобы они могли это учитывать в повседневной жизни. Также больные должны быть осведомлены и о том, что ряд лекарственных средств в своём составе могут содержать глютен, особенно, это касается таблеток, покрытых оболочкой. Медикаментозная терапия при целиакии носит симптоматический характер. Она предполагает коррекцию нарушений кишечной микрофлоры, использование антидиарейных, ферментных препаратов, поливитаминов, лекарственных средств, содержащих железо, магний и др.. Больным с рефрактерной целиакией рекомендованы глюкокортикоидные гормоны. Данная терапия оказывает значительный клинический эффект, улучшает морфологическую структуру слизистой оболочки тонкой кишки. Также при тяжёлом течении заболевания проводят коррекцию водно-электролитного, белкового, жирового и углеводного обмена. На сегодняшний день целиакия не поддаётся радикальному излечению, при ведении больных необходимо стремиться к достижению полной клинико-морфологической ремиссии заболевания. Оценка эффективности проводимой терапии осуществляется через 6, 12 мес. от её начала, далее – 1 раз в год. Критериями эффективности лечения являются: - стабилизация клинической картины; - положительная динамика гистологических изменений в слизистой оболочке тонкой кишки; - отрицательные серологические маркеры целиакии. Необходимо отметить, что антитела, специфичные для целиакии, исчезают в ходе лечения через 3-12 мес. Сохраняющиеся более указанного срока антитела свидетельствуют о недобросовестном соблюдении диеты, непреднамеренном использовании продуктов, содержащих скрытый глютен. В последние годы значительно вырос интерес к проблеме целиакии у взрослых. Во многом это можно объяснить достаточно широким распространением заболевания среди лиц средней и старшей возрастных групп, зачастую поздним диагностированием целиакии у данного контингента в силу недостаточной осведомлённости о ней врачей различных специальностей (терапевты, хирурги, врачи общей практики, акушеры-гинекологи и др.), крайней ограниченностью лечебных мероприятий (диета, симптоматическая терапия). Принимая во внимание существование генетической предрасположенности к целиакии, представляется, что расширение лечебных воздействий возможно за счёт использования методик генной инженерии.
В обзоре обсуждаются современные представления о патогенезе целиакии и классификация Marsh. «Золотым стандартом» диагностики целиакии является биопсийное исследование. Диагностически значимыми морфологическими критериями целиакии являются атрофия ворсинок слизистой оболочки тонкой кишки, гиперплазия крипт увеличение числа межэпителиальных лимфоцитов, лимфо-плазмоцитарная инфильтрация собственной пластинки. В плане лечения наиболее эффективна строгая аглютеновая диета, обсуждается возможность применения заместительной ферментной терапии. Ключевые слова: целиакия, глютен, атрофия слизистой оболочки тонкой кишки.
Дополнительное консервативное лечение и поддержание жкт (желудочно-кишечного тракта) при целиакии.
1. Цитрат магния (Очищение кишечника, улучшение нервной проводимости, обеспечение полноценного функционирования мышц, снятие симптомов усталости, поддержание здоровья зубов и костей, снижение показателей сахара в крови, повышение иммунитета.
2. L-глутамин (Рост клетки и топливо для иммунной системы – вот для чего нужен л-глютамин в человеческом организме в первую очередь поддерживает кишечный метаболизм и нормальную функцию и восстанавливает повреждение нанесенное глютеном).
3. Омега-3 рыбий жир (Противовоспалительный натуральный продукт).
4. Витамин К2 (Это жирорастворимое вещество, крайне необходимое в процессах метаболизма. Выступает как источник энергии, роста, как активный участник обменных процессов. Очищенный от примесей k₂ представляет собой кристаллический порошок желтого цвета. Способствует нормальной проницаемости кишечника).
5. Витамин D3 (Регулирует усвоение кальция, магния и фосфора, что необходимо для поддержания в нормальном состоянии костной ткани. Ускоряет процесс обмена веществ, способствует всасыванию в кишечнике соединений этих химических элементов) Алтей лекарственный (Алтей имеет выраженный обволакивающий эффект. Слизистая структура экстракта целебной культуры помогает мягко и бережно обволакивать слизистые ткани, защищая их от различных повреждений. Уменьшает воспаление в пищеварительном тракте и смягчает его). Горная мука (Диатомит) (Это горная порода с большим содержанием органического кремния Сегодня все большее количество людей обращает внимание на его роль для состояния волос, ногтей, костей и суставов. Активирует процесс детоксикации и выводит токсины из организма).
Пищевой рацион:
- Квашенная капуста домашнего приготовления исключительно на яблочном уксусе (Для нормализации микрофлоры кишечника).
- Мясной бульон (Улучшение работы ЖКТ, получение мясного коллагена).
- Кокосовое масло (Источник калорий).
- Жирная рыба (Источник калорий, фосфор).
- Авокадо (Источник калорий).
- Компот из изюма и кураги.
- Имбирь (Нормализация аппетита).
1.7. РЕФРАКТЕРНАЯ ЦЕЛИАКИЯ. СЛОЖНЫЙ КЛИНИЧЕСКИЙ СЛУЧАЙ С РАЗВИТИЕМ ОТЯГОЩЕННОГО АУТОИММУННОГО ЗАБОЛЕВАНИЯ.
Больная М. 55 лет, длительно наблюдавшейся у врачей гастроэнтерологов и проходившая лечение по заболеванию тонкого кишечника «Целиакия». В 2018 году отметила снижение массы тела, боли в околопупочной области, изжогу, нарастание астенического синдрома. Комплексно обследована: По данным МРТ ОБП от 11.2018 года: кардио-фундальная грыжа ПОД, диффузные изменения печени и поджелудочной железы, перегиб желчного пузыря, локальные рубцово-атрофические изменения в паренхиме среднего сегмента правой почки по задней ее поверхности, киста в паренхиме нижнего сегмента левой почки.
По данным ФКС от 06.2018: дивертикулез сигмовидной кишки, петлистая сигмовидная кишка, комбинированный геморрой.
Терапия: антациды, ИПП по назначению гастроэнтеролога, без клинического эффекта, прогрессирующая потеря массы тела.
В августе-сентябре 2019 года. УЗИ ОБП: диф.изменения печени и поджелудочной железы, деформация желчного пузыря. ЭГДС: недостаточность кардии, грыжа ПОД, катаральный рефлюкс-эзофагит, антральный гастрит с очаговой атрофией, дуоденит с наличием лимфангиоэктазии, HP+. Водородный дыхательный тест с лактулозой: избыточный в бактериальный рост.
В связи с прогрессированием астении на фоне снижающего веса было выполнено эндоскопическое и морфологическое, иммунологическое исследование тонкого кишечника. (АТ к тканевой трансглютаминазе IgA 16.4, IgG 3.4, АТ к диамидированным пептидам глиадина (IgG, IgA)- положит. От 09.2019 года установлен диагноз «Целиакия Marsh III b». Дивертикулезная болезнь толстой кишки без признаков дивертикулита. СИБР. ГЭРБ в эндоскопически негативной стадии. ГПОД. Хронический гастрит, ассоциированный с HP, стихающее обострение. Хронический гепатит неуточненной этиологии.
На фоне лечения Аглютеновой диеты наблюдались незначительные улучшения в общем самочувствии и состоянии. Вес продолжал снижаться. К лечению были добавлены глюкокортикостероиды «Преднизалон». Эффект лечения не дал положительной клинической картины. В начале 2020 года была выполнена повторная биопсия тонкого кишечника. По данным результата эндоскопии: Рефрактерная целиакия. Стадия Marsh III c.
В апреле 2020 перенесла Ковид (КТ-1) на фоне бронх астмы. Полностью пропало ощущение запаха и вкуса, возникли парестезии в туловище и конечностях. В июне 2020 года болезненные синюшные узловые высыпания в области стоп и середины голеней по типу "носков". Установлен диагноз узловой эритемы. Начата терапия кортикостероидами (сейчас 15мг/сут). Также в этом месяце спонтанный разрыв сетчатки левого глаза. Лазеротерапия. В сентябре 2020 - эрозия роговицы, кератит. С середины сентября 2020 года отмечала потрясывание левой ноги при закидывании нога на ногу. Осмотрена врачами, где отмечается наличие залповой стереотипной активности (ЗСА) в мышцах левого бедра, передней и задней группе. Параметры ПДЕ не изменены. Стимуляционная ЭНМГ дистальных нервов нижних конечностей не изменена. Взята кровь на антитела к LG11, CASPR2, GAD67. GAD65. Назначен клонозепам в дозе 1мг/сут, который снизил интенсивность дрожания. В процессе лечения Ходьба стала менее уверенной, пациентка неустойчива с тенденцией к падению. По данным обследования: повышение IgG, гамма-глобулинов, aLKMi 33,4 (норма до 20), ASMA 1/40 (норма 1/10), MPO, PR3, GBM -отриц. Консультирована гепатологом, на основании указанных данных заподозрен диагноз аутоиммунный гепатит, требующий верификации (в том числе биопсии печени). Диагноз исключен гистологически при госпитализации 07.2020 г.
09.2020 года отметила сухость во рту и глазах, тремор нижних конечностей. Панникулит: мезентеральный Панникулит, вероятно узловатая эритема, ст 3. Состояние после COVID-19. Нельзя исключить синдром Лефгрена. Назначено: метипред, преднизолон, плаквенил, вит Е актовегин , курантил. Целесообразно проведение биопсии малой слюнной железы для исключения с-ма Шегрена и иммуногистохимического исследования на наличие моноклональной секреции.
Синдром «сухого глаза» тяжелой степени на фоне аутоиммунного поражения: нитчатый кератит: капли дексаметазон, циклоспорин, натуральная слеза", установлены окклюдеры слезных каналов с положительным клиническим эффектом. Двухсторонний пирамидный синдром. В декабре 2020г неоднократно развивались судорожные приступы, выставлен диагноз симптоматическая эпилепсия. Так же в анамнезе бронхиальная астма (гормонзависимая со слов родственников по требованию) Состояние пациентки на протяжение времени ухудшалось. В январе 2021 года была доставлена в больницу на скорой. Основной диагноз: 163.5 Ишемический инсульт в бассейне левой средней мозговой артерии от 03.01.2020r, неуточненный патогенетический вариант Фон: Артериальная гипертензия 3 степени, III ст, риск СС04. Сопутствующий: Бронхиальная астма. Симптоматическая эпилепсия. Дивертикулярная болезнь толстой кишки без прободения и абсцесса. Целиакия, Marsh III с (по данным морфологического исследования от 07.2020r.). Интраабдоминальная и периферическая лимфаденопатия. Дивертикулярная болезнь толстой кишки без признаков дивертикулита. Мезентериальный панникуллит. Сухой синдром. Грыжа белой линии живота. Вероятно, узловая эритема, ст. 3. Нитчатый кератит. Бронхиальная астма, эндогенно-экзогенная форма, легкой степени персистирующая, вне обострения. Разрыв сетчатки от 06.2020 (курс лазерной терапии). Гиперкинетический синдром с поражением нижних конечностей. Двухсторонний пирамидный синдром.
В Январе этого же месяца пациентка скончалась. Посмертный основной диагноз: 167.8 Лейкоэнцефалопатия на фоне неуточненного системного аутоиммунного заболевания. Симптоматическая эпилепсия. Гиперкинетический синдром с поражением нижних конечностей. Двухсторонний пирамидный синдром. 2. Целиакия, Marsh III с (по данным морфологического исследования от 07.2020r.). С-м Шегрена . Синдром Лефгрена. Мезентериальный панникуллит. Узловая эритема, ст. 3. Сопутствующий: Артериальная гипертензия 3 степени, III ст, риск СС04. Полисинусит . Сухой синдром. Нитчатый кератит. Установка окклюдеры слезных каналов от 2019г Интраабдоминальная и периферическая ли1ифаденопатия. Дивертикулярная болезнь толстой кишки без прободения и абсцесса. Грыжа белой линии живота. Бронхиальная астма, эндогенно-экзогенная форма, легкой степени персистирующая, вне обострения. Разрыв сетчатки от 06.2020 (курс лазерной терапии). Осложнения: острая дыхательная недостаточность. Фульминантная пневмония. Острый реактивный септический шок на фоне иммуносупрессии. Отек головного мозга. Реанимационные мероприятия.
Проводимое лечение: микофенолата мофетил 500 мг х 2 раза в день , кеппра 500 мг х2 раза в день, омез 20 мг х 2 раза в день, метипред 1000 мг в\в капельно на физ.растворе 35, эноксипарин 0,4 мг х 1 раз в день п\к , глазные капли : максидекс 1 к х 2 раза в день, систейн по 1 кх 2 раза в день, рестазис по 1 кх 2 раза в день.
Данное клиническое наблюдение демонстрирует целиакию, длительно протекавшую скрыто и манифестировавшую с развитием клинических симптомов в зрелом возрасте и давшее начало развитию серьезного аутоиммунного заболевания, поразившего многие органы в организме. Целесообразно учесть, что целиакция является заболеванием злокачественного аутоиммунного происхождения. В современной диагностике и лечении стоит больше уделять внимание больным с поздними стадиями заболевания, чтобы избежать тяжелых осложнений данного заболевания.





