МИКРОФЛЮИДНОЕ УСТРОЙСТВО КАК СОВРЕМЕННЫЙ ЭКСПЕРИМЕНТАЛЬНЫЙ МЕТОД ВНУТРИВЕННОЙ ДОСТАВКИ КИСЛОРОДА В ОРГАНИЗМ
Секция: Медицина и фармацевтика

LIX Студенческая международная научно-практическая конференция «Естественные и медицинские науки. Студенческий научный форум»
МИКРОФЛЮИДНОЕ УСТРОЙСТВО КАК СОВРЕМЕННЫЙ ЭКСПЕРИМЕНТАЛЬНЫЙ МЕТОД ВНУТРИВЕННОЙ ДОСТАВКИ КИСЛОРОДА В ОРГАНИЗМ
Tatyana Poryakova
Student, FSBEI HE "Mordovian State University named after N.P. Ogarev," Saransk, Republic of Mordovia, Russia
Natalya Malkina
Scientific supervisor, senior lecturer FSBEI HE "Mordovian State University named after N.P. Ogarev," Saransk, Republic of Mordovia, Russia
Alexander Bolvanovich
Scientific supervisor, Candidate of Medical Sciences, assistant professor FSBEI HE "Mordovian State University named after N.P. Ogarev," Saransk, Republic of Mordovia, Russia
Аннотация. Данная статья посвящена изучению эффективности нового экспериментального метода стабилизации и поддержки пациентов с использованием микрофлюидного устройства, которое подает газообразный кислород непосредственно в кровоток пациента. Исследователи продемонстрировали, что путем сочетанного вливания газообразного кислорода и жидкого раствора через серию последовательных сопел, уменьшающихся в размере, можно создавать пузырьки кислорода размером меньше одного эритроцита по требованию и в режиме реального времени. В случае успеха описанная технология может помочь избежать или снизить частоту повреждений легких, связанных с использованием традиционных методов механической поддержки органов дыхания, однако, необходимо провести дополнительные исследования, чтобы оценить эффективность и безопасность использования микрофлюидного устройства в качестве альтернативы традиционным методам доставки кислорода.
Abstract. This article is devoted to the study of the effectiveness of a new experimental method for stabilizing and supporting patients using a microfluidic device that supplies oxygen gas directly to the patient's bloodstream. The researchers demonstrated that by a combined infusion of oxygen gas and liquid solution through a series of successive nozzles decreasing in size, it is possible to create oxygen bubbles smaller than one red blood cell on demand and in real time. If successful, the described technology may help avoid or reduce the incidence of lung damage associated with the use of traditional mechanical respiratory support techniques. However, more research is needed to evaluate the efficacy and safety of using a microfluidic device as an alternative to conventional oxygen delivery methods.
Ключевые слова: кислород, рефрактерная гипоксемия, микрофлюидное устройство, микрочастицы, нанопузырьки, внутривенное введение, диффузия кислорода.
Keywords: oxygen, refractory hypoxemia, micro fluidic device, micro particles, nano bubbles, intravenous administration, oxygen diffusion.
Введение. Рефрактерная гипоксемия – этот состояние, при котором не удается обеспечить необходимый уровень оксигенации артериальной крови пациентам с острой дыхательной недостаточностью, несмотря на проведение полноценной и адекватной кислородной терапии [1]. По данным Кембриджского медицинского и реабилитационного центра рефрактерная гипоксемия в настоящее время является серьезной проблемой в медицинской практике. Статистические данные за 2022 год свидетельствуют, что описанное патологическое состояние встречается у 5-10% пациентов отделений интенсивной терапии, а летальность больных с некорригируемой гипоксемией и острой дыхательной недостаточностью равна 16-24%. В настоящее время существуют различные способы управления рефрактерной гипоксемией, но все они имеют свои собственные побочные эффекты и ограничения [2, 3]. В связи с этим, группой ученых из Гарвардской медицинской школы и Бостонской детской больницы было разработано совершенно новое устройство для облегчения и устранения рефрактерной гипоксемии [4].
Цель исследования. Изучение эффективности применения микрофлюидного устройства для внутривенной доставки кислорода.
Материалы и методы исследования. Для выполнения работы нами были изучены научные сведения о биологических субстратах, переносящих кислород в человеческом организме. Они представляют собой три поколения микрочастиц, каждое из которых обладает определенными преимуществами и недостатками для использования в качестве носителя кислорода для инъекций [5, 6].
Из всех изученных материалов, микрочастицы липидного кислорода (lipid oxygen microparticles - LOM, 1 поколение) явились самыми благоприятными по нескольким причинам. Во-первых, они наиболее биомиметичны, так как липиды, используемые для стабилизации LOM, сходны по структуре с липидами, содержащимися в клеточных мембранах, и не вызывают токсического воздействия даже после длительного введения в высоких концентрациях [7, 8].
Во-вторых, LOM минимизируют объем материала, необходимый для введения определенного объема газа. Фосфолипиды создают монослой толщиной в 1 ангстрем (0,0000001 мм) на границе раздела газ-жидкость [9].
В-третьих, циркулирующие LOM довольно податливы, временно изменяют форму при прохождении через капилляры и образовывают мелкие мицеллы по мере уменьшения внутреннего объема, предотвращая закупорку сосудов при введении [10].
В-четвертых, LOM способны концентрировать до 70% кислорода в объеме микрочастицы, благодаря чему более высокая концентрация кислорода достигается с меньшим объемом жидкости, которую необходимо вводить в организм.
Все проводимые эксперименты были одобрены Институциональным наблюдательным советом (Institutional Review Board - IRB) Бостонской детской больницы. Для оценки микрофлюидного устройства in vivo была выбрана модель нормоксии на грызунах, в которой пузырьки кислорода из устройства вводились в бедренную вену самца крысы Sprague - Dawley. Эксперимент был проведен на девяти здоровых крысах (n=3 на группу), с использованием приборов для мониторинга гемодинамических показателей в реальном времени.
Чтобы подготовить крысу к инфузии, ей проводили анестезию и подсоединяли носовой конус для искусственного дыхания. В бедренную вену и артерию на одной ноге были введены ангиокатетеры. Венозный катетер использовался для ввода пузырьков кислорода, в то время как артериальный катетер использовался для периодического забора крови с целью мониторинга на аппарате для контроля оксигенации артериальной крови. Также был установлен дополнительный ангиокатетер в бедренную артерию на другой ноге крысы, чтобы разместить датчики давления и регистрировать систолическое и диастолическое кровяное давление. Для измерения сопротивления в легочной артерии был введен специальный катетер, а для измерения давления в левом желудочке был использован катетер объемного давления. Для проведения эксперимента животное было подготовлено при FiO2 (фракция кислорода во вдыхаемой газовой смеси) = 100%, после чего FiO2 был снижен до 30% для базового измерения в течение 10 минут.
Результаты исследования и их обсуждение
Первое исследование in vitro показало, что микрофлюидное устройство повышало насыщение кислородом (SpO2) деоксигенированной донорской крови человека с 15 до > 95% в течение нескольких секунд или минут, а эффективность составляла от 80 до 95% вводимого кислорода (рис.1).
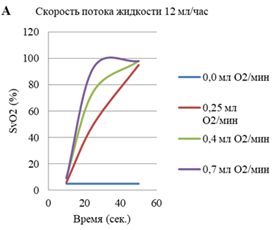
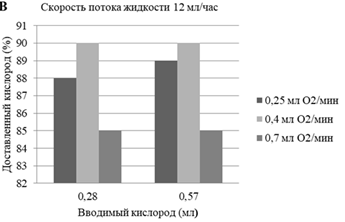
Рисунок 1. (A) Увеличение скорости потока кислорода сокращает время, необходимое для достижения насыщения. (B), что обеспечивает результативность от 80 до 95%
Дальнейшие исследования проводилось при помощи изменения скорости потока газа и жидкости (скорость введения раствора была постоянной на уровне 12 мл/ч). Все крысы были подвергнуты непрерывной инфузии кислорода в течение 30 мин при скоростях потока 0,25 и 0,4 мл/мин. После 1 часа наблюдений существенных изменений в основных гемодинамических параметрах у животных не наблюдалось. Однако при увеличении скорости потока газа до 0,7 мл/мин, были обнаружены признаки сосудистой обструкции в виде повышенного сосудистого сопротивления легких, растяжения правого желудочка и слипания микропузырьков [11, 12] (рис.2).

Рисунок 2. Микропузырьки отчетливо видны в правом желудочке (белое пятно, слева). Свободные газовые карманы очевидны в ВПВ и НПВ (справа). Скорость потока газа 0,7 мл/мин; скорость потока жидкости 12 мл/ч)
Вероятно, это связано с тем, что модель безопасности имеет свои ограничения (то есть, имело место отсутствие признаков артериальной гипоксемии).
Во время проведения инфузии со скоростью до 0,4 мл/мин. не обнаруживалось признаков острого повреждения легких или значительного взаимодействия между компонентами крови.
Полученные результаты показывают значимость тщательного контроля за скоростью введения газа в кровяное русло и необходимость индивидуального подхода к каждому отдельно взятому пациенту.
По итогу эксперимента, пиковое изменение насыщения венозного кислорода (в процентах от исходного уровня) увеличилось с 9,92% в контрольной группе до 20,04% и 34,14% при скоростях ввода кислорода 0,25 и 0,4 мл/мин соответственно. Согласно оценкам исследователей, данное увеличение соответствует повышению насыщения артериальной крови кислородом на 20-50% [4].
Таким образом, результаты эксперимента подтвердили важность и эффективность данного метода в обеспечении дополнительной оксигенации и возможность его использования в клинической практике.
Заключение
Микроприборы позволяют точно контролировать скорость и дозу введения кислорода в кровоток, что приводит к более эффективной оксигенации легких и тканей всего организма. Данные устройства не требуют эксплуатации более сложного оборудования для приготовления и введения газовой смеси, что упрощает процесс оксигенации и снижает затраты. Микрофлюидные устройства являются мобильными и удобными в применении, что позволяет использовать их в более широком диапазоне ситуаций. Микроприборы позволяют доставлять кислород непосредственно в кровоток, минуя дыхательные пути, что может быть особенно полезным при наличии тяжелых повреждений дыхательной системы. Использование микроприборов может снизить риск инфекций и травм, связанных с традиционными методами доставки кислорода. Новое устройство представляется перспективным для использования в медицине будущего, так как оно обеспечивает безопасное введение кислорода, в том числе для поддержания жизнедеятельности пациентов в течение нескольких критических минут, когда требуется срочная помощь. Использование портативного микрофлюидного устройства может дать парамедикам и врачам скорой помощи возможности для обеспечения кислородом пациентов на дому или в полевых условиях, когда другие системы кислородотерапии могут быть недоступны [13]. Появляются реальные перспективы применения микрофлюидных систем во многих областях медицины, в том числе в онкологии, генетике для доставки лекарственных препаратов в живой организм и для генно-инженерной терапии для производства лекарств в будущем [14].





