Перспектива применения 3D-биопринтинга в здравоохранении
Секция: Медицина и фармацевтика

XLIII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
Перспектива применения 3D-биопринтинга в здравоохранении
Одним из наиболее актуальных и нерешенных вопросов в сфере медицины является своевременная пересадка органов и их последующая адаптация в теле реципиента. Каждые 10 минут в список ожидающих пересадки попадает, по меньшей мере, одна новая фамилия, при этом ожидание донорского органа может занимать 10–15 лет. Нехватка биоматериала может быть объяснена нежеланием людей добровольно отдавать свои органы для последующей пересадки, исходя из морально-этических соображений и психологического фактора. Таким образом, реализованный в штате Джорджия проект, согласно которому при выдаче водительских прав лицам, согласившимся зарегистрироваться в качестве доноров, делалась скидка в размере 7–10 долларов от суммы, уплачиваемой в качестве сборов, в недавнем времени был признан недействительным. Некоторые водители, имевшие желание стать донорами в будущем, отказались от этой мысли, опасаясь, что в случае идентификации как потенциальные доноры при чрезвычайных ситуациях медработники будут менее заинтересованы в сохранении их жизней. В России более 20 тыс. человек страдают почечной недостаточностью и буквально прикованы к аппарату искусственной почки, при этом ежегодные затраты на одного пациента, нуждающегося в процедуре -jr гемодиализа, составляют свыше 2 миллионов рублей. Число пациентов с потребностью в гемодиализе в России ежегодно увеличивается примерно на 6000 человек [1].
На сегодняшний день в России нет официально-зарегистрированного рынка человеческих органов, однако даже при включении рыночного механизма в данную область, в условиях крайнего дефицита возможность быстрого приобретения и своевременной пересадки не может быть гарантирована. Согласно закону РФ «О ТРАНСПЛАНТАЦИИ ОРГАНОВ И (ИЛИ) ТКАНЕЙ ЧЕЛОВЕКА» от 22.12.92 в качестве донора может выступать близкий родственник, родители или братья, либо постороннее лицо, добровольно давшее согласие в письменной форме.
Решить проблему призвана уникальная технология 3D биопринтинга или 3D биопечати. Биопечать, как самостоятельное направление в области тканевой инженерии начало развиваться относительно недавно и нашло широкое применение в трансплантологии, имплантации и протезировании. Программное обеспечение, механические устройства подачи материала аналогичны классическому 3D принтингу, по аналогии с которым технология биопечати включает в себя: виртуальную модель органа, тканевые сфероиды, выступающие в роли заменителя чернил, специальную биобумагу – гидрогель и, наконец, биопринтер, выступающий аналогом печатного пресса.
Широкое применение в биопечати получили две техники создания 3D-печатных биоэлементов, на данном этапе развития являющиеся основными. Первая техника заключается в послойном нанесении сравнительно крупных по размеру капель тканевых сфероидов на поверхность гидрогеля. За счет специфической особенности клеток сливаться с клетками, сходными по природе и функциям, сфероиды быстро срастаются и формируют будущий сосуд, капилляр, орган. Для создания более массивных органов сфероиды наносят на каркас. При классических технологиях «инжиниринга органов» каркас изготавливается в первую очередь, он представляет собой основу будущего органа. Это может быть имплантат из искусственных материалов, стойких или разлагающихся со временем, в который врастают клетки и сосуды пациента, образуя с ним единое целое. Однако к таким материалам, как правило, предъявляются серьезные требования, удовлетворить которым очень непросто. В качестве основы имплантата можно использовать и натуральный соединительнотканный каркас органа человека, освобожденный от клеток, или орган свиньи, т.к. она является одним из самых «генетически близких» человеку животных [2].
Вторая техника, напротив, основывается на совместном распылении тканевых сфероидов и гидрогеля, что более удобно при формировании более плоских, но имеющих обширную поверхность тканей. Примером может выступать соединительная ткань. Технология выступает альтернативой привычному протезированию, имплантации и трансплантации. В случае протезирования преимущество данной методики заключается в повышенной скорости изготовления в сравнении с использованием технологий литья, легким весом протеза за счет контроля пористости изделия, ускоренным «окостенением» структуры из-за ее пористости, а в трансплантологии – создания нужного органа из клеток самого пациента, что гарантирует отсутствие реакции отторжения. Так как трансплантируемая структура воспринимается организмом как своя собственная. Более того, создание структур происходит с участием 3D моделирования, что позволяет создавать объект строго определенного размера с учетом индивидуальных особенностей организма. Технология биопринтинга базируется на явлении направленной самоорганизации клеточных структур.
На рисунке 1 хорошо видны различия в эффективности трансплантации донорских органов и 3D напечатанных структур в промежуток с 2005 по 2016 год.
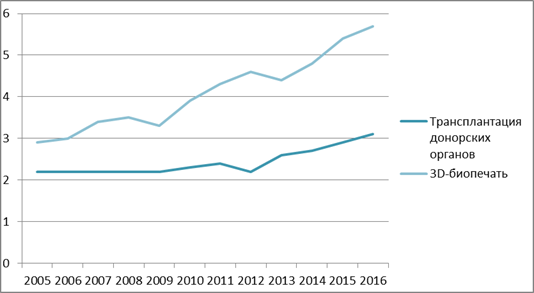
Рисунок 1. Сравнение эффективности донорских тканей и использования 3D-биопечати
В официальном сообщении 3D Биопринтинг Солюшенс подчёркнуто, что «использование технологий трёхмерной биопечати органов из аутологичных стволовых клеток пациента может стать решением проблемы иммунной совместимости. А со временем эта технология открывает возможность получения прототипов органов и эффективных способов тканезамещения, позволяющих полностью возвращать здоровье» [3].
Искусственно созданные на биопринтере ткани могут быть разделены на 4 типа согласно уровню сложности организации и, как следствие, сложности в их воспроизведении при биопечати. Классификация идет по нарастающей от простых, до наиболее трудоемких. К первому типу, представленному простыми тканями относятся двухмерные ткани, такие как кожа, далее следуют полые трубки - кровеносные сосуды, капилляры, полые органы, такие как мочевой пузырь, желудок, и, наконец, паренхиматозные органы, являющиеся наиболее сложными. Примером может служить почка. Оценить различие между категориями позволяют данные с рисунка 2.

Рисунок 2. Сравнение усложнения организации произведенный на 3D-биопринтере тканей
Помимо трансплантации искусственно созданные ткани могут быть использованы для тестирования новых лекарственных препаратов [4].
Будучи абсолютно аналогичными тканям, образовавшимся естественным путем, полученные при помощи биопечати структуры функционируют также. Поэтому проводимые на них эксперименты позволяют наблюдать реакцию организма на тот или иной препарат.
Однако, по мнению медиков, в, на первый взгляд, беспроигрышной технологии имеется ряд существенных недостатков. Основными минусами являются большие затраты биоматериала. Для выращивания полноценного органа требуются миллионы человеческих клеток. А также потребность в оборудовании для поддержания функционирования уже напечатанных структур до помещения в организм реципиента. Технология клеточной биопечати должна быть протестирована на живых организмах и сертифицирована перед началом использования на пациентах, для чего требуется много времени до реального внедрения в практику. Стоимость оборудования, его обслуживания, цена исходных материалов крайне высоки и влекут за собой соответствующую высокую стоимость услуги. Возможно, для реализации биопечати в полной мере потребуется участие государственных структур в финансировании исследований и разработок.
Результаты исследования сферы 3D биопечати и прогнозы относительно ее развития до 2020 года под названием «World 3D Printing Healthcare Market – Opportunities and Forecasts. 2014–2020» показали, что среднегодовой темп роста мирового рынка составит 26,2%. К 2020 году благодаря применению носимых устройств рынок достигнет $2,3 млрд. Для увеличения масштабов биопечати будут созданы предприятия, базирующиеся на выращивании человеческих клеток для дальнейшего использования, призванные решить проблему их дефицита. Кроме того, медицинские хирургические центры составят до 60% всего рынка 3D печати в здравоохранении [5].





