Фармаконадзор – важный инструмент в обеспечении безопасности лекарственных средств
Конференция: XXXII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Общественное здоровье и здравоохранение

XXXII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Фармаконадзор – важный инструмент в обеспечении безопасности лекарственных средств
PHARMACOVIGILANCE IS AN ESSENTIAL TOOL IN ENSURING THE SAFETY OF MEDICINES
Sholpan Kalieva
Candidate of Medicine Sciences, Associate Professor, Head of the Department of Clinical Pharmacology and Evidence-Based Medicine, NC JSC Karaganda medical university, Kazakhastan, Karaganda city
Aygerim Balkhasheva
Master student of NC JSC Karaganda medical university, Kazakhastan, Karaganda city
Аннотация. В статье предоставлено краткое изложение вопросов, обосновывающих важность изучения системы фармаконадзора для обеспечения безопасного применения лекарственных препаратов пациентами. Надзор за безопасностью лекарственных средств в значительной степени опирается на спонтанное сообщение о побочных реакциях на лекарственные средства и, таким образом, зависит от мотивации медицинских работников сообщать о наблюдаемых неблагоприятных побочных реакциях и их активного участия в этом процессе. Повышение активности медицинских работников в предоставлении сообщений о побочных действиях лекарственных средств является одной из самых приоритетных задач для надлежащего функционирования фармаконадзора.
Abstract. The article presents a summary of issues that justify the importance of studying the pharmacovigilance system to ensure the safe use of medicines by patients. Drug safety surveillance relies heavily on spontaneous reporting of adverse drug reactions, and thus depends on the motivation of health professionals to report observed adverse reactions and their active participation in this process. Increasing the activity of healthcare professionals in reporting side effects of medicines is one of the highest priorities for the proper functioning of pharmacovigilance.
Ключевые слова: фармаконадзор; мониторинг побочных действий; осведомленность; медицинские работники.
Keywords: pharmacovigilance; drug safety monitoring; awareness; medical workers.
По мнению ВОЗ, развитие нежелательных лекарственных реакций – одна из самых значительных общемедицинских проблем [65]. Например, в США, где служба учета и обработки сведений о нежелательных реакциях хорошо налажена, ежегодно от различных их видов погибают 106 000 человек [42]. По результатам исследований в США, у больных стационаров нежелательные реакции отмечают в 10,9% случаев, из них 2,1% случаев тяжелые, в 0,2%. Комплексный мета анализ показал, что НПР могут встречаться у 16,9% госпитализированных пациентов [43]. В 4,7% случаев побочные действия лекарственных средств приводят к госпитализации, а для 0,27% пациентов они становятся причиной летального исхода [3]. Наиболее частые причины летальных исходов в связи с применением лекарственных средств – желудочно-кишечные кровотечения и язвы желудка, другие виды кровотечений, поражения печени, снижение резистентности к инфекциям, аллергические реакции.
Многочисленными исследованиями было установлено, что выявление всего спектра нежелательных реакций на лекарственные средства возможно только в процессе широкого клинического применения препаратов [29]. Информация, собранная на стадии разработки фармацевтического продукта до выпуска на рынок, остается ограниченной в отношении вероятных побочных действий по нескольким причинам:
- доклинические исследования (испытания на животных) не обеспечивают гарантию безопасности лекарств для людей;
- в клинической фазе исследований участвует лимитированное количество пациентов, а условия проведения исследований отличаются от условий их использования в реальной клинической практике; помимо того, исследования проводятся в ограниченный промежуток времени;
- сведения о тяжелых и редких побочных эффектах, канцерогенности, использовании в ограниченных популяциях (к примеру, беременные женщины, дети, пожилые люди) и взаимодействиях между лекарствами зачастую недоступны в полной мере [28].
В связи с этим, возникает потребность продолжения изучения побочных эффектов фармацевтических продуктов в пострегистрационный период. Для этих целей во многих странах созданы специальные центры и службы по контролю безопасности лекарств в системе фармаконадзора.
Фармаконадзор, по определению ВОЗ, это организация деятельности, по выявлению, оценке, анализу и предотвращению нежелательных реакций на лекарства или любых других проблем, связанных с лекарствами [1]. Важнейшей задачей фармаконадзора является обеспечение безопасности выпущенных на рынок и обширно использующихся для лечения лекарственных препаратов, фармаконадзор позволяет выявить не качественные, не эффективные и контрафактные лекарственные средства, а также проводить мониторинг побочных действий лекарств [2].
В настоящее время фармаконадзор включает в себя собственные научные принципы и методологию, международные и национальные центры, научные общества, специальные журналы и веб-сайты [9], и помимо неблагоприятных побочных реакций рассматривает и другие вопросы (рисунок 1) [10]:
- ошибки применения лекарств,
- фальсифицированные и некачественные лекарственные препараты,
- недостаточная эффективность лекарств,
- злоупотребление лекарственными препаратами,
- взаимодействие между лекарственными средствами,
- смертность, вызванная применением лекарств.
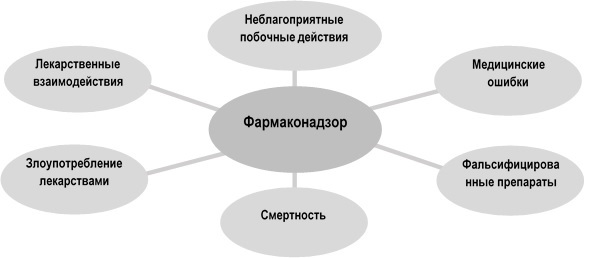
Рисунок 1. Сфера рассматриваемых вопросов фармаконадзора
История глобального фармаконадзора насчитывает более 50 лет. После катастрофы, вызванной препаратом «талидомид» в 1961 году, когда из-за тератогенного эффекта препарата более тысячи новорождённых родились с физическими уродствами, были предприняты первые систематические международные усилия по решению проблем безопасности лекарственных средств [7]. Общество и специалисты здравоохранения пересмотрели свои взгляды на проблемы нежелательных побочных реакций при применении лекарственных препаратов вследствие этой тяжелой медицинской катастрофы [5].
16-й Всемирная ассамблея здравоохранения в 1963 году приняла резолюцию 16.36, которая содержала предложение организации систематического сбора информации о серьезных побочных реакциях на лекарственные средства, наблюдаемых в ходе разработки лекарственного средства и, в частности, после его выпуска для общего применения [6]. Данная резолюция привела к созданию в 1968 году экспериментального исследовательского проекта ВОЗ – Программы по международному мониторингу лекарственных средств (Программа) [7]. Программа ВОЗ началась в 1968 году с 10 странами-партнерами. Важность фармаконадзора для общественного здравоохранения подтверждается расширением этой Программы [7]. На начало 2020 г. 138 стран – полноправных участников представляют отчеты о побочных реакциях, связанных с лекарственными средствами, в глобальную базу данных ВОЗ VigiBase, а 32 страны являются ассоциированными членами Программы.
Программа состоит из Сотрудничающего центра ВОЗ по международному мониторингу лекарственных средств в Упсале, Швеция (UMC) и Департамента фармаконадзора ВОЗ, Женева, Швейцария, и функционирует на базе координируемых национальных центров фармаконадзора [8].
В каждом государстве-участнике Программы действует свой национальный центр фармаконадзора, который ведет сбор сообщений о побочных реакциях каждый в своей стране через вовлечение всех участников системы фармаконадзора.
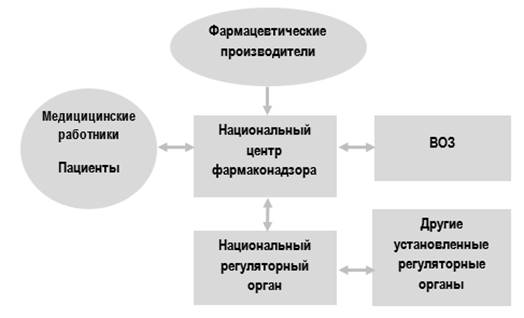
Рисунок 2. Схема взаимодействия участников системы фармаконадзора
На рисунке 2 представлена принципиальная схема взаимодействия участников системы фармаконадзора на местном, региональном, национальном и международном уровнях. На местном уровне медицинские работники и пациенты направляют сообщения о подозреваемых побочных действиях лекарственных средств (ПДЛС) в соответствующие региональные или национальные центры фармаконадзора для сопоставления, анализа и оценки. Фармацевтические производители, держатели регистрационных удостоверений выполняют ту же функцию [18]. Сообщения подвергаются анализу специалистами в национальном центре фармаконадзора, эксперты устанавливают, есть ли связь между лекарством и побочным действием, оценивают риск приема препарата в свете того, что выяснились новые нежелательные подробности их применения [24]. И если связь есть и риск оценен, как недопустимый, эксперты национального органа направляют информацию в надзорный орган о том, что в отношении препарата необходимы регуляторные меры [25]. Надзорный орган предпринимает такие меры, как внесение изменений в инструкцию по применению или иные меры, вплоть до изъятия препарата с рынка.
Данная информация также направляется в базу данных ВОЗ по отчетам о безопасности отдельных случаев (ICSR) – VigiBase. Национальные центры фармаконадзора незамедлительно получают обратную связь от UMC об итогах их сообщения, для принятия соответствующих мер. Информация о новых опасных аспектах препаратов также передается в рамках Программы между странами, тем самым предупреждая возникновение нежелательных событий. Так, например, в 2018 году органами по контролю обращения лекарственных средств и медицинских изделий Европейского союза и США (EMA и FDA) произведен отзыв с рынка серий препаратов с активным веществом «Валсартан», действующая субстанция которого изготовлена китайским производителем «Zhejiang Huahai Pharmaceuticals». Причиной регуляторных мер стало присутствие опасных веществ в некоторых партиях активной лекарственной субстанции, которую указанная фармацевтическая компания поставляет изготовителям валсартана. В субстанции был обнаружен N-нитрозодиметиламина, который опасен, как вероятный гепатотропный яд и токсичен для человека. В связи с рекомендациями международных регуляторных органов, в Казахстане приняты меры по изъятию с рынка препаратов, содержащих упомянутую субстанцию. Препараты, содержащие «Валсартан», применялись для лечения серьезных заболеваний сердечно-сосудистой системы большим количеством пациентов. Так, Программа помогла предотвратить возможные тяжелые последствия приема данных препаратов.
Таким образом, фармаконадзор состоит из структурированных процессов, в том числе: сбор сообщений о случаях НПР на лекарственные средства, анализ данных, выявление и оценка новых рисков и принятие решений о стратегиях управления рисками и их применение в здравоохранении [18,21,25,26] (рисунок 3).
Для сбора сообщений о случаях ПДЛС используются различные методы выявления неблагоприятных побочных эффектов, которые классифицируются по симптоматике, причинам и частоте возникновения.
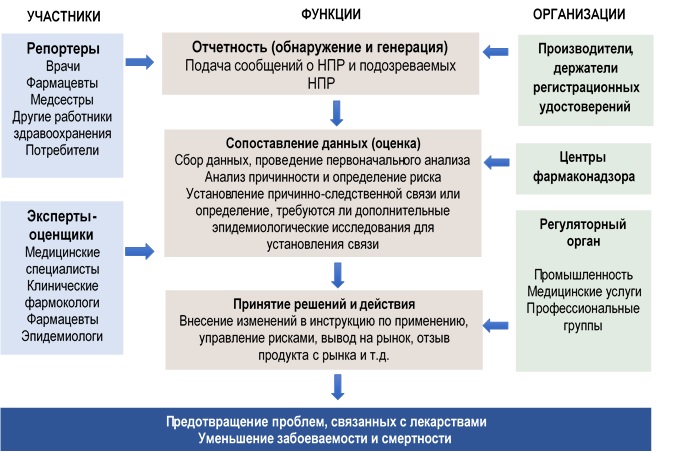
Рисунок 3. Система фармаконадзора: связь участников, функций, организаций, ожидаемый результат и влияние
По определению Всемирной организации здравоохранения, неблагоприятная побочная реакция – это любая внезапная и небезопасная для человека реакция, возникающая, когда фармацевтический препарат принимался в общеустановленных дозах для профилактики, лечения и диагностики [10]. Исторически НПР классифицировали на два типа: A и B. Реакции типа A предсказуемы из-за известного действия препарата, встречаюются чаще всего и редко приводят к смертности. Реакции типа B являются специфическими или новыми реакциями, их нельзя предсказать из-за неизвестного действия препарата, связаны с высокой смертностью и встречаются редко. Но не все побочные реакции отнесены к категориям А и В, поэтому были разработаны дополнительные категории, такие как тип C (продолжающиеся), тип D (отложенное воздействие) [23].
В работе служб и центров по фармаконадзору, так и в Программе ВОЗ используется классификация по вышеуказанным типам [11].
Достаточная численность больных, принимающих препарат, является одним из важных условий выявления НПР, в особенности редко встречающихся. Размер популяции, необходимой для выявления НПР, значительно увеличивается с повышением базовой частоты спонтанно возникающих эффектов, сходных с НПР. Следовательно, многие побочные реакции могут быть выявлены только на стадии широкого обращения препаратов на рынке [11].
Методы выявления НПР разделяются на пассивные, когда идет добровольный сбор информации от репортеров, кто участвует в приеме и назначении лекарства – пациент, медработник, производитель по мере того, как они встречаются с побочными действиями, то есть спонтанно. И активные методы, когда целенаправленно изучаются побочные действия или в определенной больнице, или по определенному препарату, или по определенной группе пациентов. Среди таких методов:
- когортные исследования,
- наблюдение типа «случай-контроль»,
- мониторинг выписываемых рецептов,
- метод учета медицинских записей о больном,
- ведение регистра пациентов,
- целенаправленные клинические исследования [44, 58].
Пассивный фармакологический надзор, основой которого считается сбор спонтанных извещений о побочных эффектах, используется в большинстве случаев пост-маркетингового наблюдения за профилем безопасности препаратов и рассматривается как рутинный метод [12].
Наиболее характерной особенностью метода спонтанных сообщений является то, что направляются не запрошенные и не смоделированные сообщения, т. е. неблагоприятные лекарственные реакции сообщаются врачами самостоятельно и не являются частью организованного сбора данных, например, клинического исследования или когортного исследования [13, 14].
С помощью данного метода может быть охвачено большое число лекарственных препаратов, пациентов различных медицинских организаций в длительной перспективе. Кроме того, метод спонтанных сообщений прост в реализации, практически не требует финансовых затрат, позволяет выявить редкие и неизвестные НПР на всем сроке пребывания препарата на рынке и быстро фиксировать клинические подозрения, которые в противном случае могут остаться незамеченными [22].
В течение последних десятилетий основой надзора за безопасностью препаратов были извещения о предполагаемых побочных эффектах лекарств от потребителей и работников практического здравоохранения [19]. Спонтанный метод сбора остается наиболее используемым в современных системах контроля обращения фармацевтических продуктов; например, во Франции и США значительная часть регулирующих действий, связанных с безопасностью, основана на спонтанных сообщениях [27, 28].
Ценность спонтанного сообщения главным образом заключается в подозрении отправителем, что лекарство вызвало определенное нежелательное событие. Большинство национальных центров фармаконадзора в настоящее время получают сообщения от всех медицинских работников и ДРУ лекарственных препаратов [22].
Чтобы лекарственный препарат получил доступ для обращения на рынке какого-то государства, производитель должен зарегистрировать его в этой стране, при этом он получает регистрационное удостоверение. Представитель производителя в какой-либо стране называется держателем регистрационного удостоверения. Держатель регистрационного удостоверения (ДРУ) в этой стране тоже может получать сообщения от пациентов или медработников и обязан об этом сообщить национальному органу.
ДРУ помимо того, что передают спонтанные сообщения, должны регулярно отчитываться национальному органу, что их препарат не превысил лимит рисков в виде плана управления рисками – Risk Management Plan (ПУР) и Periodic Safety Update Report – периодически обновляемого отчета по безопасности (ПООБ). ПУР содержит развернутое обобщение серьезных выявленных и потенциальных опасных аспектах препаратов и планирование действий по анализу, профилактике и снижению рисков из-за применения лекарственного средства. ПООБ разработан как независимый инструмент, позволяющий проводить регулярную исчерпывающую оценку мировых данных соотношения «польза-риск» и фармацевтических продуктов [3].
На основании поступающей информации о побочных действиях эксперты проводят обнаружение и оценку сигнала. «Сигнал определяется как «информация, полученная из одного или нескольких источников, включая наблюдения и эксперименты, которые предполагают новую потенциально причинную связь или новый аспект известной связи между вмешательством и событием или набором связанных событий, либо неблагоприятных, либо выгодно, что считается достаточным для обоснования подтверждающих действий». Как только потенциальный сигнал обнаружен, проводится дальнейшая оценка для подтверждения сигнала, чтобы убедиться, что имеется достаточно доказательств для обоснования дальнейшего анализа [67], [68].
После обнаружения сигнала, эксперты национальных центров фармаконадзора проверяют гипотезы о наличии причинно-следственной связи между препаратом и клиническими проявлениями, проводят анализ и оценку риска препарата. Поступающие сообщения собираются в базу данных о подозреваемых НПР [17]. Национальный орган также ответственен за распространение информации о рисках применения препарата среди медицинских работников и пациентов [26]. После получения информации от национального органа уполномоченный государственный орган принимает необходимые регуляторные меры.
Таким образом, успешность деятельности по фармаконадзору зависит от получаемых сообщений о побочных действиях [20]. Низкий уровень представления сообщений может задержать выявление новых побочных реакций, что в свою очередь не позволит провести экспертную оценку риска препарата, и не позволит регуляторному органу принять необходимые меры, направленные на профилактику развития побочных действий [16]. Чтобы выявить полный спектр осложнений, связанных с фармацевтическим лечением, и получить репрезентативную картину, все сектора системы здравоохранения должны быть вовлечены в этот процесс [1].
Однако у сбора спонтанных сообщений есть ограничения. Основным недостатком метода являются неизбежные занижения предоставления сообщений, а также качество предоставляемых сообщений. Согласно результатам 37 исследований в 12 странах, средний показатель занижения составил 94% [15]. В странах, где уровень сообщаемости достигает уровня, признанного ВОЗ приемлемым – 200 сообщений в год на 1 млн. жителей, в центры фармаконадзора поступает не более 10% сообщений от числа выявляемых серьезных НПР [16].
В таблице 1 приведены сведения о количестве полученных спонтанных сообщений о НПР в разных странах. К примеру, в Дании в 2016 году получено 7654 сообщения, при населении 5,7 млн. человек уровень сообщаемости составляет 1340 сообщений на 1 млн. жителей, в Новой Зеландии уровень сообщаемости в 2018 году составлял 911 сообщений на 1 млн. жителей, в Финляндии в 2015 году соответственно 475, и в Хорватии – 1004 [45], [46], [47], [48], [4], [59-64].
Перечисленные данные свидетельствуют о разных показателях сообщаемости о побочных действиях ЛС в разных странах. Исследование сообщений о НПР, представленных в глобальной базе VigiBase показало, что в странах с высоким уровнем дохода самые высокие показатели отчетности по НПР, а в странах с низким уровнем доходов самые низкие [54]. Функционирование систем фармаконадзора зависит от ресурсов систем здравоохранения, и в большей степени от того, как в этих странах устроены системы фармаконадзора и как долго они функционируют [49], [50], [4].
Таблица 1.
Показатели заполнения карт-сообщений разных стран
|
Страна |
Год внедрения системы фармако-надзора |
Год |
Количество карт- сообщений о ПДЛС |
Население страны, млн. человек |
Показатель заполнения карт-сообщений, количество на 1 млн. жителей |
|
Канада |
1963 |
2017 |
64617 |
36,5 |
1768 |
|
Дания |
Нет данных |
2016 |
7654 |
5,7 |
1340 |
|
Норвегия |
Нет данных |
2018 |
5623 |
5,3 |
1061 |
|
Хорватия |
1974 |
2018 |
4017 |
4,0 |
1004 |
|
Новая Зеландия |
1965 |
2018 |
4373 |
4,8 |
911 |
|
Нидерланды |
1980 |
2017 |
12777 |
17,1 |
748 |
|
Австралия |
1963 |
2015 |
17000 |
23,8 |
712 |
|
Финляндия |
1982 |
2015 |
2600 |
5,5 |
475 |
|
Великобритания |
1964 |
2016 |
17484 |
65,6 |
266 |
|
Германия |
1979 |
2017 |
15781 |
82,5 |
192 |
В некоторых странах наряду с пассивными методами фармаконадзора применяются активные методы [55]. Но их использование требует дополнительных материальных и кадровых ресурсов, и в странах с низким уровнем дохода применение активных методов фармаконадзора затруднительно [56], [57]. В этой связи на первый план выходит принятие всевозможных мер для увеличения количества сообщений при спонтанном методе. Поскольку репортерами сообщений являются потребители, пациенты, медицинские работники и ДРУ, то следует повышать их активность в этом процессе.
Что касается бизнес-процессов ДРУ, то их спонтанная отчетность является косвенной. ДРУ лишь являются передатчиками сообщений от пациентов и медицинских работников. В развитых странах их ответственность повышается в предоставлении информации через ПУР и ПООБ.
Важным репортером спонтанных сообщений являются пациенты. Во многих Европейских странах доступно направление карты-сообщения непосредственно потребителем. К примеру, в Нидерландах 55% сообщений о побочных действиях поступает от пациентов [77]. Хорошим примером служит мобильное приложение Yellow card в Великобритании [4]. На сегодня, вопрос полезности сообщений от потребителей еще является спорным, большинство исследователей склоняется к тому, что в сообщениях от потребителей есть большой потенциал, но однозначно необходимо проводить активное информирование среди потребителей и пациентов [51], [52].
Однако ведущую роль в сборе спонтанных сообщений играют несомненно работники практического здравоохранения. Разные мировые исследования приводят данные о важности их участия в этом процессе [53]. Во-первых, они назначают лекарства, и они выбирают стратегию лечения каждого пациента. Во-вторых, к ним обращаются пациенты при возникновении вопросов в лечении. Третье, они являются важным информационным звеном, именно врачи предупреждают пациентов о недостатках препаратов. И последнее, медицинские работники являются основными репортерами случаев НПР в национальный центр фармаконадзора или фармацевтическому производителю [31], [32]. К примеру, в 2015 году в Финляндии поступило до 85% информации от медицинских работников [4], а в Дании в 2016 году 62% сообщений от медицинских работников [47].
Однако многие работники здравоохранения не в полной мере осознают ту важную роль, которую они играют, помогая определить профиль пользы и риска лекарственного средства [30].
Большое количество исследований посвящено теме оценки знаний практики и отношения медицинских работников к сообщениям о побочных действиях лекарственных средств. Результаты проведенных исследований в разных странах показали, многие врачи хоть и встречаются с побочными действиями в практике, в 80% случаев не сообщают о них. Недостаточному представлению информации о НПР способствуют несколько факторов, таких как отсутствие знаний о фармаконадзоре или конкретной системе отчетности, неопределенность в отношении причинно-следственной связи между НПР и лекарственным средством, нехватка времени и убежденность в том, что следует сообщать только о серьезных или ранее неизвестных НПР и другие. Эти факторы были широко классифицированы как личные и профессиональные характеристики медицинских работников, а также их знания и отношение к предоставлению сообщений о НПР [37].
Исследование знаний об отчетности о побочных действиях лекарственных средств среди медицинских работников в Ирландии показало, что значительная часть врачей, врачей общей практики, медицинских сестер и общественных фармацевтов не обладает достаточной уверенностью в своих собственных знаниях об отчетности по побочным действиям лекарственных средств [33].
По данным исследования среди фармацевтов в Южной Корее, основными препятствиями для предоставления сообщений о побочных действиях являлись: убеждение о том, что нет необходимости сообщать о несерьезных побочных действиях, об уже хорошо известных ПДЛС и неопределенных причинно-следственных связях между побочной реакцией и лекарственным средством [34].
Согласно исследованию предвзятости в спонтанных сообщениях о побочных реакциях на лекарства в Японии, медицинские работники могут с большей вероятностью сообщать о серьезных НПР, чем сообщать о несерьезных НПР [38].
Результаты качественного исследования знаний, отношения и практики в отношении фармаконадзора среди врачей и медсестер в Индии показало, что большинство клиницистов и медперсонала в больнице были осведомлены о существовании системы отчетности НПР в Индии и ее важности, однако не обладали систематизированными знаниями в отношении отчетности о НПР [39].
Таким образом, факторы недостаточного представления информации описаны многими авторами и, хотя эти причины различаются в разных исследованиях и условиях, недостаточное представление информации о НПР является общемировым явлением [33-36].
Многочисленность факторов препятствующих предоставлению сообщений медицинскими работниками диктует необходимость проведения разнообразных мер по повышению активности репортеров [40], [41]. Среди них такие меры, как проведение образовательных мероприятий, улучшение доступности форм сообщений о побочных действиях, упрощение системы отчетности, использование информационных технологий и другие.
Таким образом, вопрос безопасности лекарств очень актуален, его серьезность признает и ВОЗ, о чем свидетельствует действующая и расширяющаяся Программа международного мониторинга безопасности лекарственных препаратов и Третий глобальный вызов безопасности пациентов ВОЗ: лекарства без вреда [66]. Система мониторинга побочных действий лекарственных средств является важным и экономически эффективным средством выявления и сведения к минимуму заболеваемости пациентов и предотвращения потенциальной смертности. Фармаконадзор может помочь лучше оценить и передать информацию об эффективности и рисках лекарств пациентам. Фармаконадзор также позволяет выявить необнаруженные некачественые, неэффективные и поддельные препараты.
Основным процессом фармаконадзора является сбор сообщений о побочных эффектах лекарств, и главный функционал в данном процессе выполняют практикующие медицинские работники. От их сознательного отношения к отчетности о ПДЛС, от их ответственного подхода к контролю безопасности лекарств во многом зависит своевременное выявление осложнений фармакотерапии и принятие необходимых мер по их профилактике. Повышение активности работников медицинских организаций в предоставлении извещений о нежелательных действиях лекарственных препаратов является одной из самых приоритетных задач для надлежащего функционирования фармаконадзора.
И в нашей стране аспект безопасности лекарственных средств актуален и требует изучения. Казахстан стал участником международной программы ВОЗ по мониторингу побочных действий лекарственных средств в 2008 году. Следует отметить, что с момента создания системы до сегодняшнего дня проведена серьезнейшая нормативная и организационная работа, однако, анализ системы фармаконадзора РК выявил ряд проблем, требующих решения и усовершенствования.
Остается актуальным вопрос повышения ответственности и активности участников фармаконадзора. Национальный регуляторный орган, субъекты здравоохранения, держатели регистрационных удостоверений, медицинские работники и пациенты должны быть готовы работать сообща, чтобы обеспечить надлежащее функционирование системы фармаконадзора [21]. Изучение опыта развитых стран поможет перенять и адаптировать наилучшие практики в решении данного вопроса.

